
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спектральный терм
|
|
Планетарная модель атома
Рассеяние a -частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a -частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: m a =7350m e. При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
Причиной рассеяния a- частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
1. в центре атома - положительно заряженное ядро:

| заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд; |

| размер ядра 10-13 см; |

| масса ядра фактически равна массе атома. |
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:

| электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. |

| число электронов в атоме равно Z (порядковый номер элемента) |

| электроны движутся с большой скоростью, образуя электронную оболочку атома. |
Модель атома, предложенная Резерфордом, называется планетарной.
Планетарная модель атома по Резерфорду.
Опыты показали, что наиболее легко удаляемой частью атома являются электроны.
В 1903 г. Дж. Томсон предложил статическую модель атома: атом представляет собой положительный заряд, в котором вкраплены колеблющиеся электроны. Эта модель не имела экспериментального подтверждения.
Для проверки гипотезы Д. Томсона и более точного определения строения атома Э. Резерфорд правёл серию опытов по рассеиванию - частиц тонкими металлическими пластинками фольгой. Основываясь на данные опыта, он предложил ядерную или планетарную модель атома, уподобляющую его солнечной системе. Согласно модели: 1) в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Ядро занимает небольшой объём внутриатомного пространства (rатома~10-10м;rядра~10-15 10-14м; т.е. rатома rядра в 105 104 раз). Положительно заряженные частицы ядра он назвал протоны(11p);
2) вокруг ядра движутся электроны, число которых определяется зарядом ядра. Атом электронейтрален;
3) сила электростатического притяжения между ядром и электронами уравновешивается центробежной силой вращения электронов, так что электроны удерживаются на своих орбитах. Атом система устойчивая. Но у этой модели были недостатки:
1. Модель не объясняла устойчивость атома. Электрон, вращаясь вокруг положительно заряженного ядра, должен излучать электромагнитную энергию в виде световых волн. Но излучая свет, электрон теряет свою энергию и приближается к ядру. Исчерпав всю свою энергию, он должен "упасть" на ядро и атом прекратит существование. Излучая энергию электрон "упадёт" на ядро через 10 минус 8 сек. Это противоречит реальным свойствам атома, т.к. атом система устойчивая.
2. Модель не объясняет линейчатость спектра атомов. При непрерывном излучении энергии спектр излучения атома должен быть сплошным, а в действительности он линейчатый.
Таким образом, теория Резерфорда не объясняла ни устойчивости атома, ни линейчатость спектра. Дальнейшие исследования Нильса Бора объяснили эти факты.
Опыты по рассеиванию частиц дали возможность Резерфорду не только обнаружить ядро в атоме, но и определить его заряд. Он определял заряд ядер атомов металлов, из которых была сделана фольга (Cu, Ag, Pb) Им были получены заряды ядер: Pb 77,4; Cu 29,3; Ag 46,3. Заряд ядра совпадал с порядковым номером элемента в периодической системе. Необходимо было установить физический смысл порядкового номера (Z).
Спектральный терм
Спектра́льный терм или электро́нный терм атома, молекулы или иона — конфигурация (состояние) электронной подсистемы, определяющая энергетический уровень. Иногда под словом терм понимают собственно энергию данного уровня. Переходы между термами определяют спектры испускания и поглощения электромагнитного излучения.
Термы атома принято обозначать заглавными буквами S, P, D, F и т. д., соответствующими значению квантового числа орбитального углового момента L =0, 1, 2, 3 и т. д. Квантовое число полного углового момента J дается индексом справа внизу. Малой цифрой вверху слева обозначается кратность (мультиплетность) терма. Например, ² P 3/2 — дублет Р. Иногда (как правило, для одноэлектронных атомов и ионов) впереди символа терма указывают главное квантовое число (например, 2² S 1/2).
Относительную энергию термов можно определить по правилу Хунда.
Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга:
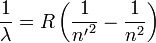 ,
,
где R = 109 677 см−1 — постоянная Ридберга для водорода, 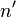 — основной уровень серии. Спектральные линии возникающие при переходах на основной энергетический уровень называются резонансными, все остальные — субординатными.
— основной уровень серии. Спектральные линии возникающие при переходах на основной энергетический уровень называются резонансными, все остальные — субординатными.
Решая совместно уравнения (2), (5), (9), получим выражение для полной энергии электрона в атоме водорода:
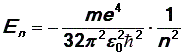
| (10) |
Уравнение (10) определяет разрешенные значения энергии электрона в атоме водорода. Число n принимает целые значения n = 1,2,3, …¥. Таким образом, энергия электрона в атоме водорода может иметь не любые значения, а только дискретный набор значений, определяемых числом n, или, как говорят, энергия электрона квантуется.
Подставляя значения массы и заряда электрона, постоянных 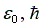 в уравнение (10) и выражая энергию в электронвольтах (эВ) (1эВ = 1,6.10-19 Дж), получим формулу
в уравнение (10) и выражая энергию в электронвольтах (эВ) (1эВ = 1,6.10-19 Дж), получим формулу
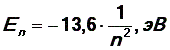
| (11) |
Энергия основного состояния (при n = 1), равна E 1 = - 13,6 эВ. На рис. 1 приведена диаграмма энергетических уровней электрона в атоме водорода, на которой горизонтальными прямыми отмечены разрешенные значения энергии. Все состояния с величиной n = 1 … ¥ являются связанными. При увеличении числа n энергетические уровни сближаются все больше и больше. При n ® ¥ E ® 0. Энергетические состояния с энергией E ³ 0 соответствуют тому, что электрон становится свободным (не связанным с ядром).
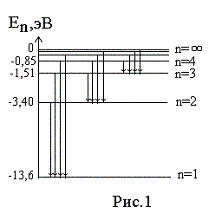 Диаграмма энергетических уровней (рис.1) позволяет дать несколько важных определений.
Диаграмма энергетических уровней (рис.1) позволяет дать несколько важных определений.
Энергия возбуждения Евоз – это энергия, которую необходимо сообщить электрону, чтобы он из основного состояния (n = 1) перешел в возбужденное. Например, Евоз = 10,2 эВ – энергия, необходимая для перехода электрона в состояние, соответствующее n = 2 (первое возбужденное состояние).
Энергия ионизации Еион – энергия, необходимая для отрыва электрона, находящегося в основном состоянии (n = 1), от ядра, т.е. для перевода электрона на уровень с n = ¥. Для атома водорода энергия ионизации равна 13,6 эВ.
Согласно постулату Бора, при переходе электрона из одного состояния (с большей энергией) в другое (с меньшей энергией) испускается фотон, частота которого определяется формулой (8). Учитывая выражение (10) для энергии электрона в атоме, получим выражение для частот испускаемых фотонов:
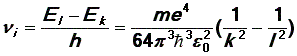
| (12) |
или, соответственно, для длин волн испускаемых фотонов:
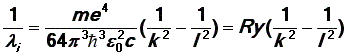
| (13) |
где Ry = 1,0974.107 м–1 – так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора объясняет дискретный (линейчатый) характер спектра испускания атома водорода.
Date: 2015-05-18; view: 2977; Нарушение авторских прав