
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические процессы реальных газов
|
|
В качестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и прежде всего в теплоэнергетике, где он является основным рабочим телом.
Процесс парообразования. Основные понятия и определения. Рассмотрим процесс получения пара. Для этого 1 кг воды при температуре 0 °С поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу Р. Тогда при площади поршня F давление будет постоянным и равным р = Р / F. Изобразим процесс парообразования, т.е. превращения вещества из жидкого состояния в газообразное, в р, v - диаграмме (рис. 4.5).
Начальное состояние воды, находящейся под давлением р и имеющей температуру 0 °С, изображается на диаграмме точкой а 0. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t = 4°С, а затем начинает возрастать. (Такой аномалией – увеличением плотности при нагревании в некотором диапазоне температур – обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно). Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой а ¢.
| Рис. 4.5. p, v - диаграмма водяного пара |
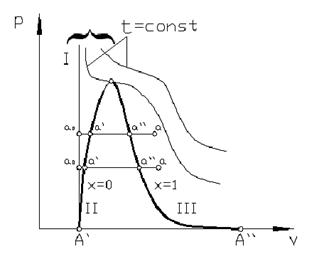
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда – смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой – растет. Температура смеси при этом остается неизменной и равной t s, так как вся теплота расходуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой а ².
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул. При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство, увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
Насыщенный пар, в котором отсутствуют взвешенные частицы жидкой фазы, называется сухим насыщенным паром. Его удельный объем и температура являются функциями давления. Состояние сухого насыщенного пара обычно задают либо давлением, либо температурой.
Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влажным насыщенным паром. Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х. Массовая доля воды во влажном паре, равная 1 – х, называется степенью влажности. Для кипящей жидкости х = 0, а для сухого насыщенного пара х = 1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
При сообщении сухому насыщенному пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка а изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки а ². Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Поскольку удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. Состояние перегретого пара, как и любого газа, определятся двумя любыми независимыми параметрами.
Если рассмотреть процесс парообразования при более высоком давлении, то можно заметить следующие изменения. Точка а 0, соответствующая состоянию 1 кг воды при 0 °С и новом давлении, остается почти на той же вертикали, так как вода практически несжимаема. Точка а ¢ смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка а ²), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки К составляют: р кр = 221,29×105 Па; t кр = 374,15°С; v кр = 0,00326 м3/кг.
Критическая температура – это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой. Все газы являются сильно перегретыми сверх Т кр парами. Чем выше температура перегрева (при данном давлении), тем ближе пар по своим свойствам к идеальному газу.
Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного пара, является давление, соответствующее тройной точке. Под последней понимается то единственное состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А ¢ на рис. 4.5). параметры тройной точки для воды: р 0 = 611 Па; t 0 = 0,01°С; v 0 = 0,00100 м3/кг. Процесс парообразования, происходящий при абсолютном давлении р 0 = 611 Па, показан на диаграмме изобарой А ¢ А ², которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом. Процесс образования пара непосредственно изо льда называется сублимацией.
Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму I, каждая точка которой соответствует состоянию 1 кг воды при 0 °С и давлении р, нижнюю пограничную кривую II, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую III, дающую зависимость удельного объема сухого насыщенного пара от давления.
Все точки между кривыми II и III соответствуют состояниям влажного насыщенного пара, точки кривой II определяют состояние кипящей воды, точки кривой III – состояния сухого насыщенного пара. Влево от кривой II до нулевой изотермы лежит область некипящей однофазной жидкости, вправо от кривой III – область перегретого пара. Таким образом, кривые II и III определяют область насыщенного пара, отделяя ее от области воды и перегретого пара, и поэтому называются пограничными. Выше точки К, где пограничных кривых нет, находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.
Поначалу трудно представить себе переход жидкости в пар без ее кипения. Чтобы понять, что в этом нет ничего необычного, рассмотрим нагрев воздуха при постоянном атмосферном давлении. Его свойства (удельный объем, внутренняя энергия и т.д.) при температуре 0 и 1000 °С будут существенно различаться, но он нигде не будет в процессе нагрева находиться в двухфазном состоянии. То же самое будет иметь место при нагреве воды, давление которой превышает критическое (скажем при р = 30 МПа).
Таблицы и диаграммы воды и пара. Сегодня имеются достаточно надежные уравнения состояния водяного пара, аналогичные уравнению Клапейрона для идеальных газов, но они слишком сложны, поэтому в инженерных расчетах пользуются таблицами и диаграммами.
Для расчетов обычно используют таблицы двух видов (см. Приложение):
- насыщенный пар и вода на линии насыщения;
- вода и перегретый пар.
При изменении давления от 0,1 до 40 ат температура кипения (°С) может быть приблизительно посчитана по формуле
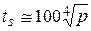 ,
,
в которую давление надо подставлять в атмосферах.
Для грубой ориентировки можно также привести такие цифры:
| р, ат | ||||||
| р, МПа | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 |
| t s, °С | ||||||
| t s, °С (точно) | 99,1 | 119,6 | 132,9 | 142,9 | 151,1 | 158,1 |
(легко запомнить: при давлении р = 2 ат, ts @ 120 °С, а дальше при повышении давления на каждую атмосферу величина ts повышается примерно на 10 °С; это правило «работает» до р @ 6 ат (0,6 МПа)).
В принципе, поскольку ts = f (p), аргументом в таблице первого рода можно использовать как давление, так и температуру. Практически для удобства пользователей таблицы «насыщенный пар и вода на линии насыщения» приводят и по давлениям и по температурам. В них термодинамические величина со штрихом относятся к воде при температуре кипения, а с двумя штрихами – к сухому насыщенному пару.
В таблицах Приложения для расчета свойств воды и перегретого пара аргументами являются давление и температура.
Поскольку для изобарного процесса подведенная к жидкости 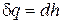 (уравнение (2.28)) теплота и следовательно q = h 2 – h 1, то, применив это соотношение к процессу а ¢ а ², получим
(уравнение (2.28)) теплота и следовательно q = h 2 – h 1, то, применив это соотношение к процессу а ¢ а ², получим
q = r = h ² – h¢. (4.35)
Величина r называется теплотой парообразования и определяет количество теплоты, необходимой для превращения одного килограмма воды в сухой насыщенный пар той же температуры.
Поскольку состояния кипящей воды и сухого насыщенного пара определяются только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения v ¢, v ², h ¢, h ², s ¢, s ², r.
Удельный объем v х, энтропия s х и энтальпия h х влажного насыщенного пара определяются по правилу аддитивности. Поскольку в 1 кг влажного пара содержится х кг сухого и (1 – х) кг кипящей воды, то
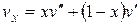 . (4.36)
. (4.36)
Аналогично
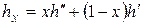 . (4.37)
. (4.37)
Однофазные состояния некипящей воды и перегретого пара задаются двумя параметрами. По заданным давлению и температуре из расчетных формул, приведенных в приложении находят значения v, h, s.
В Приложении приведены аппроксимационные формулы для расчета энтальпии и удельного объема воды h ¢, v ¢ и h ², v ²на линии насыщения, а также перегретого пара. Поскольку формулы достаточно громоздкие, на практике предпочитают пользоваться диаграммами, изображение процессов в которых к тому же нагляднее.
Т, s - диаграмма водяного пара. Она широко используется для анализа циклов паросиловых установок.
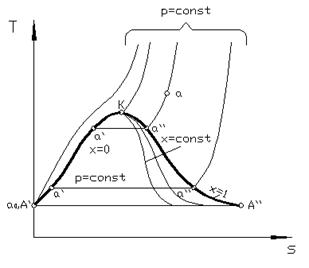
| Рис. 4.6. T, s - диаграмма водяного пара |
Состояние воды в тройной точке (s 0 = 0; Т 0 = 273,16 К) изображается в диаграмме (рис. 4.6) точкой А. Откладывая на диаграмме для разных температур значения s¢ и s ², получим нижнюю и верхнюю пограничные кривые. Влево от нижней пограничной кривой располагается область жидкости, между пограничными кривыми – двухфазная область влажного насыщенного пара, вправо и вверх от верхней пограничной кривой – область перегретого пара.
На диаграмму наносят изобары. При р = const 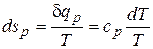 . Считая в первом приближении теплоемкость не зависящей от температуры, после интегрирования запишем
. Считая в первом приближении теплоемкость не зависящей от температуры, после интегрирования запишем 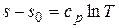 или потенцируя, получим, как и для идеального газа, экспоненциальную зависимость температуры от энтропии
или потенцируя, получим, как и для идеального газа, экспоненциальную зависимость температуры от энтропии 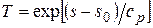 . Поскольку теплоемкость пара все же зависит от температуры, реальные изобары несколько отклоняются от экспоненты. Так как теплоемкость воды почти не зависит от давления (если оно не слишком велико), то для воды, не догретой до температуры ts кипения, все изобары практически совпадают друг с другом и сливаются с нижней пограничной кривой и лишь при очень высоких давлениях идут чуть выше ее. При достижении ts начинается кипение (точка а ¢) и дальше изобара совпадает с изотермой (горизонтальная прямая на Ts диаграмме). Точка а ² изображает сухой насыщенный пар. После нее (для перегретого пара) изобара имеет качественно такой же (экспоненциальный) вид, как и для идеального газа.
. Поскольку теплоемкость пара все же зависит от температуры, реальные изобары несколько отклоняются от экспоненты. Так как теплоемкость воды почти не зависит от давления (если оно не слишком велико), то для воды, не догретой до температуры ts кипения, все изобары практически совпадают друг с другом и сливаются с нижней пограничной кривой и лишь при очень высоких давлениях идут чуть выше ее. При достижении ts начинается кипение (точка а ¢) и дальше изобара совпадает с изотермой (горизонтальная прямая на Ts диаграмме). Точка а ² изображает сухой насыщенный пар. После нее (для перегретого пара) изобара имеет качественно такой же (экспоненциальный) вид, как и для идеального газа.
Иногда на T, s - диаграмме наносят линии х = const (рис. 4.6).
Область диаграммы, лежащая ниже изотермы Т = 273 К, отвечающая различным состояниям смеси пар + лед, обычно не строится.
h, s - диаграмма (рис 4.7). Она широко применяется для расчета процессов в паросиловых двигателях.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения s ¢ и h ¢ для воды при температуре кипения, а также s ² и h ² для сухого насыщенного пара, получаем нижнюю и верхнюю пограничные кривые.
| Рис. 4.7. h, s - диаграмма водяного пара |
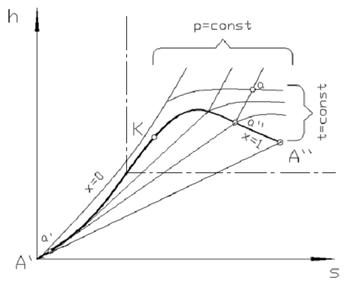
Изобары в двухфазной области влажного пара представляют собой пучок расходящихся прямых. Действительно, в процессе р = const ds = δ q p/Т = dh / T, или (∂ h /∂ s)p = T, т.е. тангенс угла наклона изобары в h, s - координатах численно равен абсолютной температуре данного состояния. Так как в области насыщения изобара совпадает с изотермой, тангенс угла наклона постоянен и изобара является прямой. Чем выше давление насыщения, тем выше температура, тем больше тангенс угла наклона изобары, поэтому в области насыщения прямые р = const расходятся. Чем больше давление, тем выше лежит изобара. Критическая точка К лежит не на вершине, как это было в р, v - и Т, s - диаграммах, а на левом склоне пограничной кривой.
В области перегретого пара температура (при постоянном давлении) растет с увеличением s примерно по экспоненциальной кривой и крутизна изобары увеличивается. Аналогичный характер имеют изобары и в области воды, но они идут так близко от пограничной кривой, что практически сливаются с ней.
При низких давлениях и относительно высоких температурах перегретый пар по своим свойствам близок к идеальному газу. Так как в изотермическом процессе энтальпия идеального газа не изменяется, изотермы сильно перегретого пара идут горизонтально. При приближении к области насыщения, т.е. к верхней пограничной кривой, свойства перегретого пара значительно отклоняются от свойств идеального газа и изотермы искривляются.
В h, s - диаграмме водяного пара часто наносят также линии v = const, идущие круче изобар.
Обычно всю диаграмму не выполняют, а строят только ее верхнюю правую часть, наиболее употребительную в практике расчетов. Это дает возможность изображать ее в более крупном масштабе (см. штрих-пунктирные линии на рис. 4.7).
Контрольные вопросы и задачи
4.1. Воздух по объему состоит из 21 % кислорода и 79 % азота. Определить состав воздуха по массе, парциальные давления кислорода и азота при давлении смеси 760 мм рт. ст. и плотность воздуха при нормальных физических условиях, считая его идеальным газом.
4.2. 1 кг воздуха при температуре 10 °С и начальном давлении 0,1 МПа сжимается изотермически в компрессоре до конечного значения 1 МПа. Определить конечный объем, затраченную работу и количество теплоты, которое необходимо отвести от газа.
4.3. Как известно, в атмосфере существуют конвекционные токи, непрерывно перемещающие воздух из верхних слоев в нижние, а из нижних – в верхние. Когда воздух поднимается в верхние слои с более низким давлением, он адиабатически расширяется (ибо является плохим проводником теплоты) и его температура понижается. Считая воздух идеальным газом, вычислить высотный градиент температуры в атмосфере.
4.4. 3 м3 воздуха при начальном давлении 4×105 Па расширяются до трехкратного объема и давления р 2 = 105 Па. Считая процесс политропным, вычислить показатель политропы, работу расширения, количество теплоты и изменение внутренней энергии в этом процессе.
4.5. Перегретый пар расширяется в турбине по адиабате от начального давления 8 МПа и температуры 500 °С до р 2 = 10 кПа. Определить конечное состояние пара, изменение внутренней энергии и работу расширения.
Date: 2015-05-09; view: 1341; Нарушение авторских прав