
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтальпия
|
|
В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
Н = U + рV. (2.25)
Поскольку входящие в нее величины являются функциями и параметрами состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Величина
h = u + pv, (2.26)
называемая удельной энтальпией (h = Н / М), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг.
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
h = ψ1(p, v); h = ψ2(v, T); h = ψ3(p, T),
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физически энтальпия представляет собой сумму внутренней энергии и работы, которую надо совершить над рабочим телом, чтобы оно заняло объем v при постоянном давлении р. То есть это своеобразная «полная» энергия рабочего тела.
Как увидим дальше (при изложении первого закон термодинамики для открытых систем) энтальпия очень широко используется в теплотехнических расчетах.
По этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии.
Для идеального газа, дифференцируя, (2.26) с учетом соотношения (18) 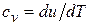 и уравнения (1.4)
и уравнения (1.4) 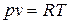 , найдем
, найдем
 . (2.27)
. (2.27)
Добавляя и вычитая vdp в уравнение первого закона термодинамики, получим 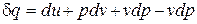 и учитывая первое равенство (2.27), окончательно запишем
и учитывая первое равенство (2.27), окончательно запишем
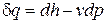 . (2.28)
. (2.28)
Это есть выражение первого закона термодинамики для закрытой системы через энтальпию.
Контрольные вопросы и задачи
2.1. 1 л воды нагревается с помощью электрического кипятильника мощностью 300 Вт. За какое время вода нагреется до температуры кипения при атмосферном давлении, если теплообмен с окружающей средой отсутствует, а начальная температура воды равна 20 ˚С?
2.2. Найти среднюю удельную теплоемкость азота в интервале температур 1000 – 2000 ˚С, если известно, что в интервале температур 0 – 2000 ˚С она равна 1,19 кДж/(кг×К), а в интервале температур 0–1000 ˚С – 1,12 кДж/(кг×К).
2.3. Стальной брус высотой 2 м и сечением 100 см2 находится под нагрузкой 100 т. Надо ли учитывать работу расширения при расчете теплоты на нагрев бруса от 0 до 200 °С? Плотность стали 7,8 г/см3, коэффициент линейного расширения 0,000013 К-1, удельная теплоемкость стали 0,46 кДж/(кг×К).
2.4. Какая доля теплоты, подведенной к 1 кг кислорода в изобарном процессе, затрачивается на изменение внутренней энергии?
Date: 2015-05-09; view: 1028; Нарушение авторских прав