
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия. В 1865 г. Р. Клазиус ввел еще одну функцию – энтропию s
|
|
В 1865 г. Р. Клазиус ввел еще одну функцию – энтропию s. Запишем формулу
 . (3.1)
. (3.1)
Подставив в нее из первого закона термодинамики для закрытой системы  с учетом того, что для идеального газа
с учетом того, что для идеального газа 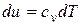 , а
, а  (из уравнения Клапейрона), получим
(из уравнения Клапейрона), получим
 . (3.2)
. (3.2)
Взяв неопределенный интеграл от левой и правой частей равенства (3.2), считая для простоты cv =const, получим
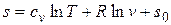 . (3.3)
. (3.3)
Если теплоемкость cv зависит от температуры, суть дела от этого не меняется, просто первый член в правой части формулы (3.3) будет иметь более сложное выражение. Величину s 0 можно подсчитать с помощью теоремы В. Нернста (1906) - М. Планка (1912), но в задачах технической термодинамики важно лишь изменение энтропии в процессе, т.е. разность двух значений, при расчете которой величина s 0 выпадает. Поэтому в технической термодинамике s, также как u и h, отсчитывается от произвольного уровня.
В соответствии с формулой (3.3) изменение энтропии идеального газа в процессе 1–2 рассчитывается по формуле
 . (3.4)
. (3.4)
Аналогично можно рассчитать энтропию не только для идеальных газов, но и для реальных рабочих тел.
Еще раз подчеркнем, что энтропия есть функция состояния рабочего тела. Её изменение зависит только от начальных и конечных параметров процесса и не зависит от пути перехода от одних параметров к другим (пути процесса). Это видно из формулы (3.4).
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов T, s - диаграмму, на которой (как и на p, v - диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс – линией (рис. 3.1)
Из уравнения  (3.1) следует, что в равновесном процессе
(3.1) следует, что в равновесном процессе
 ; (3.5)
; (3.5)
 . (3.6)
. (3.6)
Очевидно, что в T, s - диаграмме элементарная теплота процесса d q изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
| Рис. 3.1. Графической изображение теплоты в T, s – координатах |
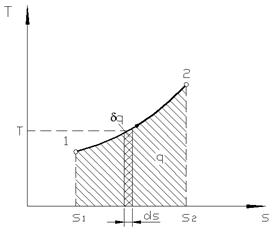
Формула (3.5) показывает, что ds и d q имеют одинаковые знаки. Следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (d q >0) его энтропия возрастает (ds >0), а при отводе теплоты (d q <0) – убывает (ds <0).
Date: 2015-05-09; view: 1052; Нарушение авторских прав