
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Объединяя оба закона, можно записать
|
|
 (9.1)
(9.1)
где m –масса вещества, окисленного или восстановленного на электроде, г; М э − масса моля эквивалентов (молярная масса эквивалентов) вещества, г/моль экв.; М − молярная масса вещества, окисленного или восстановленного на электроде, г/моль; Z − эквивалентное число (количество электронов, участвующих в электродных реакциях, Z = n  ); Q − количество электричества, прошедшего через электролизер (Кл), равное произведению силы тока I (А) на время прохождения тока
); Q − количество электричества, прошедшего через электролизер (Кл), равное произведению силы тока I (А) на время прохождения тока  (с); F – число Фарадея, равное 96500 Кл/моль.
(с); F – число Фарадея, равное 96500 Кл/моль.
Если превращению на электродах подвергаются газы, то объединяющее оба закона Фарадея уравнение (9.1) может быть записано как
 (9.2)
(9.2)
где V – практически выделившийся или поглощенный объем газа, л; V Э – эквивалентный объем газа,  , л/моль экв; 22,4 л/моль – объем моля газа при н. у.
, л/моль экв; 22,4 л/моль – объем моля газа при н. у.
С учетом законов Фарадея можно определить скорость процесса электролиза как число молей веществ, претерпевших электрохимическое превращение на единице площади поверхности электрода в единицу времени:

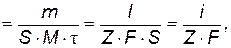

 (9.3)
(9.3)
где  - скорость электродного процесса, моль/(м2·с); i – плотность тока, А/м2.
- скорость электродного процесса, моль/(м2·с); i – плотность тока, А/м2.
Тогда плотность тока может быть рассчитана по уравнению:

 . (9.4)
. (9.4)
Используя законы Фарадея можно рассчитать величину тока и время, необходимые для выделения (или растворения) на электродах определенного количества вещества, или при заданных значениях тока и времени проведения процесса, вычислить массу вещества, осаждаемого (или растворяющегося) на электродах.
Например, если в результате реакции Cu2+ + 2 
 Cu на электроде выделилось 63,54 г меди, то теоретическое количество электричества, прошедшее через электрод, равно:
Cu на электроде выделилось 63,54 г меди, то теоретическое количество электричества, прошедшее через электрод, равно:

Или, если в результате реакции 2Н+ + 2 
 Н2
Н2  на электроде выделилось при нормальных условиях 5,6 л водорода, то теоретическое количество электричества можно определить из соотношения:
на электроде выделилось при нормальных условиях 5,6 л водорода, то теоретическое количество электричества можно определить из соотношения:

При электролизе во многих случаях выделяется вещества меньше теоретически рассчитанного. Поэтому вводится понятие выход по току − ( ).
).
Выход по току ( ) − это отношение фактически полученного при электролизе количества вещества к теоретически рассчитанному его количеству на основании законов Фарадея.
) − это отношение фактически полученного при электролизе количества вещества к теоретически рассчитанному его количеству на основании законов Фарадея.
Обычно выход по току выражается в процентах:
 %. (9.5)
%. (9.5)
С учетом этого выражение (9.1) приобретает вид:
 (9.6)
(9.6)
Date: 2015-10-19; view: 498; Нарушение авторских прав