
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения типовых задач. Пример 1. Рассчитайте количество меди, выделенное на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А
|
|
Пример 1. Рассчитайте количество меди, выделенное на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А.
Решение. Катодный процесс: Cu2+ + 2 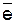
 Cu. Количество меди рассчитываем по уравнению закона Фарадея (9.1):
Cu. Количество меди рассчитываем по уравнению закона Фарадея (9.1):
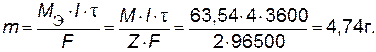
Пример 2. Рассчитайте силу тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях.
Решение. Катодный процесс: 2Н2О + 2 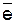 ↔ Н2
↔ Н2  + 2ОН-.
+ 2ОН-.
Величину тока рассчитываем из уравнения (9.2) по формуле:

Пример 3. Вычислите, сколько граммов КОН образовалась у катода при электролизе водного раствора K2SO4, если на аноде выделилось 1,2 л кислорода, измеренного при нормальных условиях.
Решение: Электролиз раствора K2SO4 протекает по следующей схеме:
К2SO4 + Н2О
↑↓
(−) K (Pt)  2K+ + SO42
2K+ + SO42 
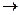 (+) A (Pt);
(+) A (Pt);
(−) К: 2Н2О + 2 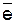 ↔ Н2
↔ Н2 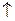 + 2ОН- (+) А: 2Н2О ↔ O2
+ 2ОН- (+) А: 2Н2О ↔ O2 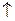 + H+ + 4
+ H+ + 4 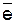 ;
;

2Н2О ↔ 2Н2 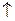 +O2
+O2 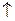 .
.
Объем моля эквивалентов кислорода (н.у.) равен 22,4/4=5,6 л. Следовательно, 11,2 л кислорода составляет 2 моль эквивалентов. Столько же, т.е. 2 моль эквивалентов КОН, образовалось у катода или 56,11 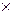 2=112,22 г (56,11 г – масса 1–го моля эквивалентов КОН).
2=112,22 г (56,11 г – масса 1–го моля эквивалентов КОН).
Пример 4. Рассчитайте, сколько граммов чистой соли необходимо для получения 71 г хлора электролизом водного раствора NaCl (выход по току 100 %).
Решение. Электролиз раствора NaCl протекает по следующей схеме:
2NaCl + 2Н2О
↑↓
(−) K (Pt)  2Na+ + 2Cl
2Na+ + 2Cl 
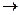 (+) A (Pt);
(+) A (Pt);
(−) К: 2Н2О + 2 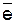 ↔ Н2
↔ Н2 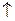 + 2ОН- (+) А: 2Cl
+ 2ОН- (+) А: 2Cl  ↔ Cl2 + 2
↔ Cl2 + 2 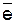 ;
;

2NaCl + 2Н2О  Н2
Н2  + Cl2 + 2NaОН.
+ Cl2 + 2NaОН.
Масса 1 моля эквивалентов хлора равна 71:2=35,5 г. Следовательно, 71 г хлора составляет 2 моль эквивалентов. Столько же, т.е. 2 моля эквивалентов NaCl необходимо взять для электролиза или 58,5  2=117 г (58,5 г – масса 1-го моля эквивалентов NaCl) при
2=117 г (58,5 г – масса 1-го моля эквивалентов NaCl) при  =100%.
=100%.
Пример 5. Вычислите массу разложившейся воды и объемы водорода и кислорода при н.у., выделившихся на электродах при электролизе водного раствора Н2SО4 током силой 10 А в течение 1 ч.
Решение. Используя объединенное выражение законов Фарадея (9.2), рассчитаем объемы водорода и кислорода:
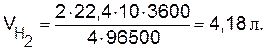
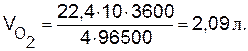
Электролиз водного раствора Н2SО4 протекает по следующей схеме:
(−) К: 4Н+ + 4 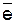 ↔ 2Н2
↔ 2Н2 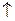 ;
;
(+) А: 2Н2О ↔ О2 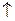 + 4Н+ + 4
+ 4Н+ + 4 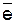 ;
;

2Н2О ↔ 2Н2 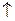 + О2
+ О2 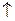 .
.
Рассчитываем эквивалентный объем кислорода при н.у.:
VЭ = 22,4/4=5,6 л/моль экв
и определяем число эквивалентов кислорода:
n э = V/Vэ =2,09/5,6=0,373 моль экв.
Согласно закону эквивалентов такое же количество эквивалентов, т.е. 0,373 моль экв., разложилось воды. Зная молярную массу эквивалентов Н2О, рассчитаем ее массу:
m (H2O)=Mэ 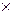 n э=(18/2)
n э=(18/2) 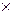 0,373=3,36 г.
0,373=3,36 г.
Пример 6. Рассчитайте толщину слоя цинка, выделившегося в течение 30 мин на железном катоде площадью 800 см2 при электролизе раствора ZnCl2 силой тока, равной 2,5 А. Коэффициент выхода по току равен 0,8. Плотность цинка  = 7,15 г/см3.
= 7,15 г/см3.
Решение. В соответствии с уравнением (9.8)


 Zn = 2
Zn = 2  10-3 мм.
10-3 мм.
Date: 2015-10-19; view: 1218; Нарушение авторских прав