
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коррозия металлов в растворах электролитов при различных значениях рН
|
|
Коррозия металлов в средах, имеющих ионную проводимость, протекает через стадию анодного окисления металла
Ме  Меn+ + n
Меn+ + n  .
.
В зависимости от активности металлов и от рН среды наиболее вероятна реализация одного из двух видов катодного процесса.
1. Восстановление ионов водорода и выделение Н2 на катодных участках:
(+) К: 2Н+ + 2 
 2Н2
2Н2  (рН
(рН  7).
7).
Протекание этого процесса возможно, если E  < E
< E  .
.
Коррозия металлов, при которой катодная реакция осуществляется с выделением водорода, называется коррозией металлов с водородной деполяризацией.
Равновесный потенциал водородного электрода, вычисленный по уравнению Нернста при парциальном давлении водорода p  =1 атм, равен E
=1 атм, равен E  , E
, E  =−0,059 рН.
=−0,059 рН.
Значения равновесного потенциала водородного электрода в зависимости от рН для парциального давления водорода  =0,1 МПа представлены в табл. 10.1.
=0,1 МПа представлены в табл. 10.1.
Таблица 10.1
Равновесный потенциал водородного электрода при 25 оС в зависимости от рН среды
Давление водорода  , МПа , МПа
| E  , Е , Е  = −0,059 рН, В = −0,059 рН, В
| ||
| рН среды | |||
| 0,1 | 0,000 | −0,415 | −0,828 |
В нейтральной среде при отсутствии кислорода все металлы, имеющие электродный потенциал более отрицательный, чем −0,415 В будут восстанавливать водород из воды:
(+) К: 2Н2О + 2 
 Н2
Н2  + 2ОН- (рН
+ 2ОН- (рН  7).
7).
В щелочной среде коррозии подвергаются только щелочные и щелочноземельные металлы, а также алюминий и марганец.
2. Восстановление кислорода О2:
в нейтральной или щелочной среде
(+) К: О2 + 2Н2О + 4 
 4ОН- (рН
4ОН- (рН  7);
7);
в кислой среде (рН< 7)
(+) К: О2 + 4Н+ + 4 
 2Н2О.
2Н2О.
Равновесный потенциал кислородного электрода, вычисленный по уравнению Нернста при парциальном давлении водорода p  =1атм, равен Е
=1атм, равен Е  /
/  , Е
, Е  /
/  =1,229–0,059рН.
=1,229–0,059рН.
Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода, называется коррозией с кислородной деполяризацией.
С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере или соприкасающиеся с водой и растворами солей. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
В табл. 10.2 приведены зависимости значений равновесного потенциала кислородного электрода от рН.
Таблица 10.2
Равновесный потенциал кислородного электрода при 25 оС в зависимости от рН среды
Давление кислорода
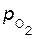 , МПа , МПа
| Е  / /  , Е , Е  / /  = 1,229 – 0,059рН, В = 1,229 – 0,059рН, В
| ||
| рН среды | |||
| 0,1 | +1,229 | +0,815 | +0,401 |
В качестве примера рассмотрим процесс коррозии стали (сталь – сплав на основе железа с содержанием углерода от 0,02 до 2,06 %). Роль анода играют структурные составляющие сплава, обладающие отрицательным электродным потенциалом (например, зерна феррита – твердый раствор углерода в железе), а роль катода – структурные составляющие или примеси, потенциал которых наиболее положителен (например, Fe3C – карбид железа).
На анодных участках поверхности происходит процесс окисления металла:
(−) А (Fe): Fe  Fe2+ + 2
Fe2+ + 2  .
.
На катодных участках (Fe3C) протекают процессы восстановления. В зависимости от условий и состава окружающей среды эти процессы могут быть различны. На поверхности металлов и сплавов в атмосферных условиях всегда имеется тонкая адсорбционная пленка влаги, растворяющая О2, СО2, SO2, HCl и другие вещества, содержащиеся в окружающей среде. Растворенные вещества могут принимать участие в катодном процессе в качестве окислителя.
Наиболее распространенными являются следующие катодные процессы:
Восстановление кислорода, растворенного в воде
(+) K (Fe3C): 4OH- + 4 
 2H2O + O2
2H2O + O2  (pH
(pH  7).
7).
Восстановление ионов водорода
(+) K (Fe3C): 2Н++ 2 
 Н2
Н2  (рН < 7).
(рН < 7).
При атмосферной коррозии железа и его сплавов конечным продуктом коррозии является ржавчина, которая образуется в результате взаимодействия продуктов анодного и катодного процессов на поверхности металла:
Fe2++ 2OH-® Fe(OH)2;
4Fe(OH)2 + O2 + 2H2O ® 4Fe(OH)3  .
.
Последнее уравнение представляет собой упрощенную схему. В действительности процесс окисления и гидратации идет более сложно и наряду с Fe(OH)3 образуются такие вещества, как FeOOH, Fe2O3, Fe3O4 в различных соотношениях.
Date: 2015-10-19; view: 1142; Нарушение авторских прав