
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ЭЛЕКТРОЛИЗ. Основные понятия электролиза
|
|
Основные понятия электролиза
Электролизом называется окислительно-восстановитель-ный процесс, протекающий при прохождении электрического тока, подаваемого от внешнего источника, через раствор или расплав электролита.
При этом энергия постоянного электрического тока превращается в химическую энергию.
Электролиз проводится в электролизерах, представляющих собой электрохимическую ячейку, состоящую из двух соединенных с внешним источником тока электродов, помещенных в электролит. В электролите перенос электричества осуществляется направленным перемещением ионов: положительно заряженные ионы − катионы движутся к катоду − электроду, подключенному к отрицательному полюсу внешнего источника тока, а отрицательно заряженные ионы – анионы – к аноду, подключенному к положительному полюсу внешнего источника тока. На катоде происходит восстановление катионов, на аноде – окисление анионов.
Для исключения взаимодействия продуктов электролиза, образующихся на катоде и аноде, применяют электролизеры с диафрагмами или мембранами. Наиболее эффективны ионнообменные мембраны, проницаемые только для ионов одного знака. Катоды обычно изготавливают из графита, стали, Pt Ni, аноды − из Pt, Ni, нержавеющей стали, графита, а также Тi, покрытого оксидами металлов. Как правило, используют перфорированные электроды, что позволяет увеличить их поверхность.
Количественные соотношения при электролизе подчиняются законам Фарадея.
При прохождении тока электроды и вся система в целом переходят в неравновесное состояние, которое сопровождается изменением электродных потенциалов по сравнению с равновесными значениями. Электроды, потенциал которых отличается от равновесного потенциала, называются поляризованными, а само явление – электродной поляризацией.
Различают катодную  и анодную
и анодную 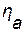 поляризацию.
поляризацию.
В результате поляризации потенциал анода смещается в положительную сторону, потенциал катода – в отрицательную сторону.
В ряде случаев поляризация при электролизе играет положительную роль. Например, вследствие поляризации выделения Н2 удается осадить при электролизе водных растворов солей многие металлы, для которых равновесные потенциалы более отрицательны, чем потенциал водорода. Это Fe, Pb, Sn, Co, Ni, Zn, Cd, Cr.
Разрядка в водных растворах ионов Сl-, а не ОН- в растворах с высокой концентрацией электролита объясняется высокой поляризацией кислорода.
Date: 2015-10-19; view: 691; Нарушение авторских прав