
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классификация коррозионных процессов
|
|
Коррозия – самопроизвольное разрушение металла вследствие его окисления при взаимодействии с окружающей средой.
Причина коррозии − термодинамическая неустойчивость металлов в различных средах при данных внешних условиях, вследствие чего почти все они встречаются в природе в окисленном состоянии: в виде оксидов, сульфидов, силикатов, алюминатов, сульфатов и т.д.
С точки зрения термодинамики коррозия металлов – самопроизвольный процесс, сопровождающийся уменьшением энергии Гиббса ( < 0). Чем отрицательнее значение
< 0). Чем отрицательнее значение  , тем выше термодинамическая возможность коррозионного процесса.
, тем выше термодинамическая возможность коррозионного процесса.
Термодинамика позволяет определить только возможность или невозможность протекания коррозии, но не дает принципиальных представлений о скорости и механизме этого процесса. Поэтому при изучении процесса коррозии важнейшее значение имеют также кинетические закономерности.
Коррозия протекает на границе двух фаз «металл/окружающая среда», т.е. является многостадийным гетерогенным процессом и подчиняется законам химической кинетики для гетерогенных реакций.
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. Сущность процессов химической коррозии сводится к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла к окислителю.
На практике химическая коррозия встречается при действии на металлы сухих газов (воздуха, продуктов горения топлива и др.) и жидких неэлектролитов (органических растворителей, жидкого топлива).
Входящие в состав жидкого топлива углеводороды и органические растворители не активны по отношению к металлам и не разрушают их. Коррозионную активность сообщают нефти растворенные в ней сернистые соединения (меркаптаны) − (R –SH), которые вызывают коррозию Cu, Ni, Со, Pb, Sn и других металлов с образованием их меркаптидов (M −(SR)n).
Присутствие воды увеличивает коррозионную активность сырой нефти, содержащей тиоспирты и сероводород. H2S реагирует с Fe, Pb, Cu, Ag с образованием сульфидов:
2Cu + H2S + O2 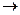 2CuS + H2 O.
2CuS + H2 O.
Наиболее распространенным видом химической коррозии является газовая коррозия. Коррозия металлов обычно протекает при высоких температурах в газах и парах агрессивных веществ, когда исключена возможность их конденсации на поверхности металла, и поэтому ее часто называют высокотемпературной газовойкоррозией.Это коррозия лопаток турбин, сопел ракетных двигателей, элементов электронагревателей, а также коррозия в процессах термической обработки в металлургической промышленности (при горячей прокатке, закалке, ковке). К коррозионным газовым агентам относятся O2, H2O, CO2, SO2, H2S, Cl2 и др.
Коррозия под действием продуктов сгорания топлива. Продукты сгорания топлива (угля, мазута и др.) в большинстве случаев содержат значительные количества соединений серы и ванадия. Под действием соединений серы железоуглеродистые сплавы подвергаются межкристаллитной коррозии из-за большего числа дефектов в кристаллических решетках сульфидов по сравнению с решетками оксидов.
С повышением содержания в продуктах сгорания топлива оксида углерода (II) заметно снижается скорость газовой коррозии углеродистых и низколегированных сталей, однако при очень высоких его концентрациях возможно науглероживание поверхности:
3Fe + 2CO 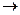 Fe3C + CO2
Fe3C + CO2  .
.
Науглероживание поверхности стали происходит и при нагревании ее в атмосфере углеводородов.
Коррозия железа, стали, чугуна в атмосфере, содержащей О2,СО2, Н2О. При нагревании железа и сталей на их поверхности образуется окалина, имеющая сложное строение. Из-за большего объема образующихся оксидов компонентов чугуна размеры детали увеличиваются, а ее прочность снижается.
В стали и чугуне наряду с окислением железа происходит взаимодействие карбида железа с кислородом и кислородосодержащими реагентами:
Fe3C + O2  3Fe + CO2,
3Fe + CO2,
Fe3C + CO2  3Fe + 2CO.
3Fe + 2CO.
При этом поверхностный слой обедняется углеродом (так называемое обезуглероживание), что ухудшает механические и антикоррозионные свойства.
Для защиты от газовой коррозии применяют жаростойкое легирование (например, хромом, алюминием, кремнием), защитные покрытия (главным образом, металлические и термодиффузионные покрытия алюминием, хромом и жаростойкие эмали), а также различные защитные атмосферы (Ar, N2, N2 – CO2 и др.).
Примером химической коррозии в неэлектролитах служит разрушение цилиндров двигателей внутреннего сгорания. Борьбу с химической коррозией в жидких неэлектролитах ведут путем подбора устойчивых в данной среде металлов и сплавов (например, алюминий и его сплавы).
Наибольший вред приносит электрохимическая коррозия.
Электрохимическая коррозия протекает в средах с хорошей ионной проводимостью. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя.
Этот вид коррозии наиболее распространен. К электрохимической коррозии относится взаимодействие металлов с жидкими электролитами (водой, водными растворами солей, кислот, щелочей, расплавленными солями и щелочами), влажным воздухом, почвой и т.д.
Электрохимическая коррозия очень часто является следствием образующихся на металле микрогальванических элементов за счет дифференциации его поверхности на катодные и анодные участки. Причины этого могут быть различны:
а) неоднородность металла (неоднородность сплава по химическому и фазовому составам, наличие примесей в металле, оксидных и других пленок на его поверхности и др.);
б) неравномерное распределение окислителя на границе металл/электролит, например, различная влажность или аэрация;
в) неоднородность наложения внешних условий (неодинаковая температура отдельных участков поверхности металла, различный уровень механических напряжений одной и той же детали и др.).
Согласно теории локальных коррозионных элементов процесс электрохимической коррозии представляет собой совокупность двух протекающих на различных участках металла процессов:
а) анодный процесс, сопровождающийся окислением металла на его анодных участках и переходом ионов металла в раствор:
(−) А: Ме  Меn+ + n
Меn+ + n  ;
;
б) катодный процесс, сопровождающийся восстановлением окислителя (Ox) на его катодных участках:
Ох + n 
 Red.
Red.
В технике обычно применяют металлы в виде сплавов, отличающихся химической и физической неоднородностью, поэтому в большинстве практических случаев, при коррозии происходит локализация анодных и катодных процессов на различных участках металла, которые в зависимости от их размеров образуют короткозамкнутые макрогальванические (различимые невооруженным глазом) или микрогальванические (различимые только в микроскоп) элементы. Таким образом, электрохимическая коррозия металлов напоминает работу гальванического элемента. При коррозии металлов обычно образуются гальванические элементы второго и третьего типов.
Основным отличием процессов электрохимической коррозии от процессов в гальванических элементах является отсутствие тока в цепи. Электроны в процессе коррозии не выходят из металла, а перемещаются внутри металла от анодных участков к катодным.
Коррозия как самопроизвольный процесс протекает, если энергия Гиббса реакции  < 0. При работе гальванического элемента А max=−
< 0. При работе гальванического элемента А max=−  = n
= n  F
F  ∆E, где ∆Е = E к− Е а, n – число электронов; F – число Фарадея.
∆E, где ∆Е = E к− Е а, n – число электронов; F – число Фарадея.
Потенциал анодного участка равен Е анод = Е металл. Потенциал катодного участка определяется окислительно-восстановительным потенциалом окислителя.
Таким образом, принципиальная возможность протекания процесса электрохимической коррозии определяется потенциалом металла в данных условиях и электродным потенциалом окислителя.
Самопроизвольное протекание коррозионного процесса возможно при условии, что равновесный окислительно-восстановительный потенциал окислителя положительнее равновесного потенциала восстановителя (металла) в данных условиях, т.е.
Е  > E
> E  . (10.1)
. (10.1)
Date: 2015-10-19; view: 579; Нарушение авторских прав