
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Иммобилизация ферментов микрокапсулированием
|
|
Микрокапсулирование является одним из широко применяемых в последнее время методов физической иммобилизации, который, сохраняя фермент в растворе фактически в нативном состоянии, дает возможность использовать его многократно, отделяя фильтрацией от продуктов реакции. Оболочка, непроницаемая для фермента и высокомолекулярных соединений, находящихся во внешней среде, позволяет в то же время свободно диффундировать через нее низкомолекулярным веществам, например субстратам и продуктам.
В настоящее время существуют три основных метода заключения ферментов в полупроницаемые мембраны: межфазная поликонденсация, межфазная коацервация и двойное эмульгирование. При первом методе образование мембраны происходит в ходе химической реакции на поверхности раздела фаз, при втором - мембрана образуется за счет понижения растворимости полимера на границе раздела фаз. Двойное эмульгирование - это модификация метода межфазной коацервации, которая заключается в следующем. Водный раствор, содержащий фермент, эмульгируется в растворе полимера (в органическом растворителе), затем полученная эмульсия диспергируется в водной фазе с образованием твердых сфер, содержащих водные микрокапли с включенным ферментом. Преимуществами этого метода являются достаточно мягкие условия приготовления биокатализатора, возможность выбора любых значений рН и практическая несжимаемость капсул даже в отсутствии наполнителей.
6.1.2. Химические методы иммобилизации ферментов
Главным отличительным признаком химических методов иммобилизации является то, что путем химического воздействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности, между белком и носителем.
Иммобилизация ферментов путем образования новых ковалент- ных связей между ферментом и носителем - наиболее массовый способ получения промышленных биокатализаторов. В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает стерические трудности в осуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки, в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, глутаровый диальдегид и др.) (рис. 6.2).
 Носитель Вставка Фермент Иммобилизованный
фермент
Рис. 6.2. Схема иммобилизации фермента химическим методом
Носитель Вставка Фермент Иммобилизованный
фермент
Рис. 6.2. Схема иммобилизации фермента химическим методом
|
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Число методических приемов, разработанных для осуществления ковалентной иммобилизации ферментов, исключительно велико. Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента. Ниже представлен ряд примеров, иллюстрирующих некоторые способы химической иммобилизации ферментов.
Иммобилизация ферментов на носителях, обладающих гидроксигруппами
| —OCN —OH |
| H |
| H |
| H |
| —OH |
| цианат |
| носитель |
Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем является бром- циановый метод. При обработке носителя бромцианом возникают реак- ционноспособные цианаты и имидокарбонаты, которые при взаимодействии с нуклеофильными аминогруппами фермента образуют производные изомочевины и уретанов: —OH
CNBr
_O^C=NH имидокарбонат
| H | —O-C—NH— | Ф |
| —OH |
| O |
| производное уретана |
| Ф |
| H2N- |
| H | —O-C-NH— | Ф |
| —OH |
| производное изомочевины |
| NH |
Иммобилизация ферментов на носителях, обладающих аминогруппами
Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазония, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, аминные, гуанидиновые, тиольные группы белков. Так, в щелочной среде фенольные радикалы тирозина образуют прочные азосоединения, в составе которых белок связан с носителями:

|
| H |
| \\ // |
| -N=N + HO- |
фенольный радикал фермента
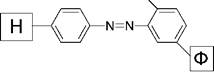
|
| HO |
| азосоединение |
Иммобилизация ферментов на носителях, обладающих активированными производными карбоксильной группы
| W // |
| Ф |
| соль диазония |
Наиболее часто для соединения аминогрупп белка с ацильными группировками носителя используют ангидриды, галогенангидриды, ак
тивированные эфиры и другие производные карбоновых кислот. Например:
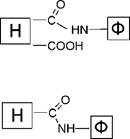
|
| O о -о |
| H |
| ;о р Cl |
| -о |
| H |
| —C |
+ h2n—[ф~|
Иммобилизация на носителях, обладающих сульфгидрильными группами
Сульфгидрильные группы носителя и фермента легко окисляются с образованием дисульфидных связей под действием кислорода воздуха:
[O]
H —sh + sh—[ф ------------- - H — s-s—[ф]
Иммобилизация путем химического присоединения биокатализатора к носителю отличается высокой эффективностью и прочностью связи. Несмотря на это, методы ковалентной иммобилизации ферментов все еще малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются незаменимыми инструментами в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. Иными словами, при достаточно широком варьировании условий, таких, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких, как субстратная специфичность, каталитическая активность и стабильность. Именно химическими методами путем многоточечного ковалентного закрепления белковой структуры удается достигнуть наибольших эффектов стабилизации ферментов.
6.2. ПРИМЕНЕНИЕ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
Иммобилизованные ферменты нашли широкое применение в таких областях, как медицина, сельское хозяйство, аналитическая химия и органическая химия.
Иммобилизованные ферменты имеют огромное значение для медицины. В частности, большой рынок сбыта занимают тромболитиче- ские ферменты, предназначенные для борьбы с сердечно-сосудистыми заболеваниями. Так, в отечественную клиническую практику внедрен препарат «стрептодеказа», содержащий стрептокиназу - активатор предшественника протеиназы плазмина, предотвращающий образование тромба в кровеносной системе.
Ферменты, разрушающие некоторые незаменимые аминокислоты (например, аспарагиназа), используют для борьбы со злокачественным ростом опухолей. Протеолитические ферменты (трипсин, хемотрипсин, коллагеназа), иммобилизованные на волокнистых материалах (целлюлозе, полиамидных волокнах, декстране и др.), применяют для эффективного лечения ран, язв, ожогов, абсцессов, а их белковые ингибиторы - в заместительной терапии для лечения эмфиземы и панкреатитов.
Исключительно важны с практической точки зрения работы, посвященные направленному транспорту лекарственных веществ. В этом отношении особенно выгодны инкапсулированные ферменты типа искусственной клетки. Так, микрокапсулы, стенки которых представлены оболочкой эритроцита, а их содержимое заполнено ферментом аспара- гиназой, переносятся кровотоком к зонам скопления аспарагина и поэтому часто применяются для лечения аспарагинзависимых опухолей, в частности саркомы. Колонки, заполненные микрокапсулами с ферментом уреазой, используют для диализа в аппарате «искусственная почка», которая работает в 100 раз эффективнее обычного аппарата. Принцип работы такой колонки следующий: мочевина разлагается уреазой до аммиака, который далее адсорбируется на активированном угле или
ионообменной смоле:
диффузия в уреаза _ + адсорбция на
мочевина----------------------- мочевина ---------- hco3 + nh4----- смоле или акти-
микрокапсулу вированном угле
Из попыток применения иммобилизованных ферментов в мелкомасштабном производстве следует отметить их использование для трансформации стероидов. Так, например, применяемый при лечении артрита кортизол можно получить из дешевого предшественника 11- дезоксикортизола в колонне с иммобилизованной 11-Р-гидроксилазой, затем кортизол можно перевести в еще более ценный лекарственный препарат преднизолон в реакторе со слоем Д-дегидрогеназы. В настоя
щее время подавляющее большинство трансформаций стероидов в промышленном масштабе осуществляют микробиологическим путем.
| ch2oh I 2 c=o |
| ch2oh c=o |

| ioh |
| 11-дезоксикортизол |

| иммобилизованная |
| 11-Р -гидроксилаза |
| но |
| 'ioh |
| кортизол |
| иммобилизованная А -дегидрогеназа |
| ch3 |
| о |
| o |
ch2oh
I 2 c=o

| преднизолон |
| o |
'ioh
Иммобилизованные ферменты широко применяются в аналитической химии. Одним из примеров могут служить электроды с иммобилизованными ферментами, позволяющие осуществлять непрерывный контроль за низкими концентрациями биохимически важных веществ. Так, в электроде для определения мочевины (рис. 6.3) иммобилизованная уреаза разлагает мочевину на ионы, которые могут быть обнаружены обычными электрохимическими методами.
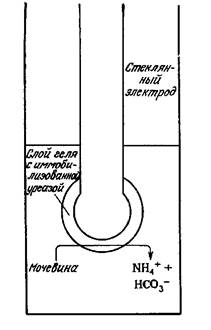 Рис. 6.3. Электрод для определения мочевины
Рис. 6.3. Электрод для определения мочевины
|
Таким образом, использование иммобилизованных ферментов во многих жизненно важных отраслях народного хозяйства становится все более массовым. Выгодное сочетание избирательности и эффективности с долговечностью и стабильностью иммобилизованных ферментов в корне меняет химическое производство, способы добывания сырья, способствует созданию новых биотехнологических процессов и методов терапии, совершенствует медицинскую диагностику, анализ, органический синтез и оказывает огромное влияние на образ жизни человека.
6.3. ПРОМЫШЛЕННЫЕ ПРОЦЕССЫ С ИСПОЛЬЗОВАНИЕМ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
В настоящее время лишь несколько процессов с использованием иммобилизованных ферментов имеют крупномасштабное применение. Эти процессы следующие:
1. Получение 6-аминопенициллановой кислоты с помощью иммобилизованной пенициллинамидазы (Россия, Япония, Финляндия).
2. Получение глюкозо-фруктозных сиропов с использованием иммобилизованной глюкозоизомеразы (США, Великобритания, Голландия, Финляндия, Дания, Япония).
3. Разделение рацемических смесей аминокислот с использованием иммобилизованной аминоацилазы (Япония).
4. Получение безлактозного молока с использованием иммобилизованной лактазы (Чехия, США, Италия).
6.3.1. Разделение рацемических смесей аминокислот
Потребность в L-аминокислотах для производства пищевых продуктов и в медицинских целях постоянно возрастает. В связи с этим большое внимание уделяется разработке как микробиологических, так и химических методов получения L-аминокислот. Недостатком химических методов является рацемическая природа синтетических аминокислот. В общем случае D-аминокислоты не имеют питательной ценности, поэтому желательно получать только физиологически активные L- аминокислоты.
Указанная цель была достигнута в процессе, разработанном фирмой Tanabe Seiyaku Co., Ltd. (Япония), в котором впервые в промышленном масштабе применялись иммобилизованные ферменты. Основой процесса является метод разделения оптических изомеров в соответствии со следующей реакцией, катализируемой ферментом аминоацила- зой:
nhcor
| аминоацилаза |
i
dl- r—c—cooh + h2o h
dl-аминокислота
nhcor1 nhcor-i
i 1 i 1 l- r-c-cooh + d- r—c—cooh hh
l-аминокислота d-ациламинокислота
Эту реакцию осуществляют в реакторах колонного типа с иммобилизованной аминоацилазой. Общая схема процесса приведена на рис. 6.4.
 Рис. 6.4. Технологическая схема процесса с применением иммобилизованной аминоацилазы
Рис. 6.4. Технологическая схема процесса с применением иммобилизованной аминоацилазы
|
Для разделения смеси рацемическую аминокислоту переводят в ацилированную форму и подвергают действию фермента аминоацила- зы, разрушающего ацильную связь и высвобождающего свободную аминокислоту. Фермент гидролизует амидную связь только L-изомера. В результате получается смесь свободной L-аминокислоты и ацилиро- ванной D-аминокислоты. Эти вещества, как правило, имеют разную растворимость (чаще всего в воде, иногда в других растворителях), поэтому их довольно легко разделить путем дробной кристаллизации. Оставшийся после разделения D-изомер нагревают, в результате чего он рацемизуется, после этого разделение повторяют до тех пор, пока весь изомер не перейдет в L-форму (обычно выходы превосходят 90 %).
Промышленный процесс заключается в следующем. Через колонну, заполненную аминоацилазой, иммобилизованной ионными связями на DEAE-сефадексе, пропускают раствор рацемической модифициро
ванной по аминогруппе аминокислоты. После колонны раствор осторожно упаривают в вакууме: при концентрировании раствора первым выпадает в осадок менее растворимый компонент (как правило, это ацилированный D-изомер). Далее раствор фильтруют и упаривают еще раз для выделения свободной L-аминокислоты. D-Изомер растворяют и нагревают, при этом он рацемизуется, и его возвращают в колонну. В итоге добиваются высокой концентрации L-аминокислоты. Фермент аминоацилаза мало чувствителен к типу аминокислоты, поэтому одна установка с иммобилизованным ферментом может использоваться для получения самых разных аминокислот. Когда активность фермента падает, добавляют порцию свежего катализатора (один раз в несколько лет).
6.3.2. Производство кукурузного сиропа с высоким содержанием
фруктозы
Этот процесс с использованием иммобилизованных ферментов наиболее важен с экономической точки зрения.
Сахар (сахарозу) нельзя заменить D-глюкозой, поскольку глюкоза менее сладкая. К тому же кристаллизация концентрированных растворов глюкозы может затруднить их последующую переработку и хранение. Эти осложнения могут быть устранены, если глюкозу частично изомеризовать во фруктозу с помощью фермента глюкозоизомеразы:
| CHO OH H -OH -OH |
CH2OH
| H- HO- H- H- |
| H |
| OH OH CH2OH |
| CH2OH D-глюкоза |
|=O
глюкозо-
HO-
изомераза H- H
D-фруктоза
При 50 оС константа равновесия этой реакции близка к единице, и изменение температуры практически не влияет на нее, поскольку теплота реакции изомеризации составляет всего лишь около 1 ккал/моль, поэтому продуктом реакции является смесь глюкозы и фруктозы в отношении приблизительно 1:1. Такая смесь значительно более сладка, чем чистая глюкоза и может с успехом заменять сахар в самых различных областях, в том числе в производстве безалкогольных напитков, приготовлении различных пищевых продуктов и в хлебопекарной промышленности.
Глюкозоизомераза представляет собой внутриклеточный фермент, продуцируемый рядом микроорганизмов, из которых используются главным образом некоторые штаммы Arthrobacter и Streptomyces. Необ-
ходимость дезинтеграции клеток достаточно мягкими методами, не вызывающими необратимую инактивацию фермента, приводит к повышению стоимости глюкозоизомеразы по сравнению, например, с внеклеточными гидролазами. К тому же глюкозоизомераза очень чувствительна к ряду ингибиторов. Оба эти фактора предполагают целесообразность иммобилизации глюкозоизомеразы.
На рис. 6.5 приведена схема процесса производства кукурузного сиропа с высоким содержанием фруктозы, основанного на использовании иммобилизованной глюкозоизомеразы. Здесь необходимость множества операций разделения и обработки промежуточных продуктов между стадиями осахаривания и изомеризации диктуется свойствами ферментных систем. Так, для повышения устойчивости a-амилазы, применяемой для гидролиза крахмала (обычно этот процесс проводят при температуре около 105 оС) добавляют ионы кальция. Последние, однако, ингибируют глюкозоизомеразу, и поэтому их связывают ионообменными смолами прежде, чем декстрозный раствор поступит в реактор изомеризации.
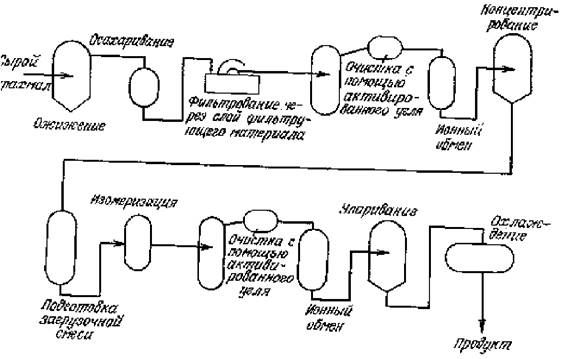 Рис. 6.5. Схема процесса производства кукурузного сиропа с высоким
содержанием фруктозы
Рис. 6.5. Схема процесса производства кукурузного сиропа с высоким
содержанием фруктозы
|
Date: 2015-09-24; view: 3925; Нарушение авторских прав