
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные этапы промышленного получения антибиотиков
|
|
После установления высоких лечебных свойств первого антибиотика - пенициллина сразу же возникли задачи организации его производства в больших количествах. На первом этапе промышленное получение этого препарата носило примитивный, экономически нерентабельный характер. Выращивание продуцента антибиотика осуществлялось на средах, находящихся в небольших сосудах, при поверхностном культивировании гриба. Процесс развития гриба продолжался 8-10 суток. Такой способ культивирования гриба при большой затрате труда давал весьма низкий выход антибиотика, и себестоимость препарата была соответственно очень высокой. В результате поисков путей наиболее рационального способа производства антибиотика был предложен метод глубинного выращивания гриба в специальных емкостях- ферментаторах при продувании воздуха и перемешивании культуральной жидкости.
Современное промышленное получение антибиотиков - это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий:
1. Стадии биосинтеза (образования) антибиотика. Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии - создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика.
Высокая результативность стадии зависит от уровня биосинтетической активности продуцента антибиотика, времени его максимального накопления, стоимости сред для культивирования организма, в том числе стоимости применяемых предшественников, а также общих энергетических затрат на процессы, связанные с развитием продуцента антибиотического вещества.
2. Стадии предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделение культу- ральной жидкости от биомассы продуцента). Эффективность стадии во многом определяется составом среды для выращивания продуцента антибиотика, характером его роста, местом основного накопления биологически активного вещества (в культуральной жидкости или внутрикле- точно).
3. Стадияи выделения и очистки антибиотика. На этой стадии, в зависимости от свойств антибиотика, его химического строения и основного места накопления антибиотического вещества, применяют различные методы выделения и очистки. В качестве основных методов используются экстрация, осаждение, сорбция на ионообменных материалах, упаривание, сушка.
Особенность этой технологической стадии определяется тем, что на первой стадии работы имеют дело с небольшой концентрацией (~1 %) антибиотика в обрабатываемом растворе, тогда как на последующих этапах его концентрация увеличивается до 20-30 %. Все это требует применения различных емкостей и объемов используемых реагентов.
4. Стадии получения готовой продукции, изготовления лекарственных форм, расфасовки. Особенность стадии определяется очень высоким требованиям к качеству конечного продукта. В случае выпуска антибиотиков, предназначенных для инъекций, препараты должны быть стерильными; получение таких антибиотических препаратов, приготовление различных лекарственных форм, дозировка (расфасовка) и упаковка должны осуществляться в асептических условиях.
Для максимального выхода антибиотика при культивировании продуцента используют комплекс мер, включающих подбор наиболее благоприятных для этих целей питательных сред и режимов культивирования организма. Весь этот комплекс мер включается в понятие «управляемый биосинтез».
В промышленных условиях управляемый биосинтез требует строгого соблюдения технологического процесса как на стадии подготовки инокулята, так и на стадии биосинтеза. На стадии подготовки инокулята особое внимание обращают на состав среды, на которой выращивается организм, на возраст клеток или мицелия. На стадии биосинтеза, кроме состава среды, большую роль играют скорость потребления тех или иных компонентов, предшественники, регуляция процесса аэрации культуры, поддержание соответствующих температуры и рН среды и других показателей режима культивирования.
В современных условиях производства принимают меры к максимальному снижению себестоимости препаратов путем интенсификации всех стадий технологического процесса и, прежде всего, повышением эффективности первой стадии - биосинтеза антибиотического вещества. Для этого необходимо:
а) внедрение в производство наиболее высокопродуктивных штаммов микроорганизмов - продуцентов антибиотиков;
б) создание и обеспечение самых благоприятных условий развития продуцента антибиотика на относительно дешевых средах;
в) широкое использование математических методов планирования процесса развития организма и электронно-вычислительной техники с целью оптимизации и моделирования условий его культивирования, обеспечивающих максимальный выход антибиотика;
г) применение современного оборудования на всех стадиях технологического процесса с автоматизированными контролирующими устройствами основных параметров развития организма и стадий биосинтеза антибиотика.
Методы культивирования продуцентов антибиотиков
В современных условиях наиболее перспективным методом выращивания микроорганизмов-продуцентов антибиотиков признан метод глубинного культивирования. Метод состоит в том, что микроорганизм развивается в толще жидкой питательной среды, через которую непрерывно подается стерильный воздух, и среда перемешивается.
Существует четыре основных модификации глубинного способа выращивания микроорганизмов.
1. Периодическое культивирование. При этом способе весь процесс развития микроорганизмов полностью завершается в одном ферментаторе, после чего ферментатор освобождается от культуральной жидкости, тщательно промывается, стерилизуется и вновь заполняется свежей питательной средой. Среда засевается изучаемым микроорганизмом, и процесс возобновляется.
2. Отъемный метод. Культивирование микроорганизмов осуществляется в ферментаторах с периодическим отбором части объема культуральной жидкости в ферментаторе и доводится свежей питательной средой до исходного уровня.
3. Батарейный способ. Микроорганизмы развиваются в ряду последовательно соединенных ферментаторов. Культуральная жидкость на определенной стадии развития микроорганизма перекачивается из первого ферментатора во второй, затем из второго в третий и т. д. Освобожденный ферментатор немедленно заполняется свежей питательной средой, засеянной микроорганизмом. При этом способе выращивания микроорганизмов емкости используются более рационально.
4. Непрерывное культивирование. В основе метода лежит принцип непрерывного протока питательной среды, что позволяет поддерживать развитие микроорганизма на определенной стадии его роста. Стадия развития микроорганизма определяется тем, что в этот период происходит максимальный биосинтез антибиотика или другого биологически активного соединения.
Установлено, что в условиях непрерывного процесса биосинтеза некоторых антибиотиков можно получить хорошие результаты, если процесс вести в две стадии. В первом аппарате батареи поддерживают высокую скорость потока, обеспечивающую большую скорость роста продуцента антибиотика, с тем, чтобы получить высокоактивную биомассу, а во втором аппарате - обеспечивают низкую скорость потока и соответственно небольшую скорость роста. Процесс непрерывного культивирования - перспективное направление современной биотехнологии.
Стерилизация питательных сред
Для каждого продуцента антибиотика разрабатывается оптимальная питательная среда. Среда должна соответствовать определенным требованиям:
а) обеспечивать максимальный выход антибиотика;
б) состоять из относительно дешевых компонентов;
в) иметь хорошую фильтрующую способность;
г) обеспечивать применение наиболее экономичных приемов выделения и очистки антибиотиков.
Стерилизация питательных сред в промышленных условиях осуществляется двумя методами: периодическим и непрерывным.
Периодический метод стерилизации применяется при использовании небольших объемов среды и состоит в том, что среда нагревается до температуры 120-130 оС непосредственно в ферментаторах или в специальных котлах-стерилизаторах, выдерживается при этой температуре в течение 30-60 минут (в зависимости от объема среды и ее состава), после чего охлаждается до 27-30 оС.
За время, затрачиваемое на нагрев среды до температуры, необходимой для стерилизации, и ее охлаждение, уничтожается значительное число микроорганизмов. Эффект стерилизации и сохранение термолабильных веществ достигаются в том случае, если стерилизацию проводят при более высокой температуре и за более короткое время.
Непрерывный метод стерилизации целесообразно применять при использовании больших объемов среды. Приготовленная среда из специального сосуда с помощью насоса подается в стерилизационную колонну, через которую пропускают острый пар (давление пара около 505 Па). Пар подают сверху по внутренней трубе, имеющей щелевидные прорези, благодаря чему он поступает в среду, быстро ее нагревая. Среда в колонну подается снизу и движется по спирали вокруг внутренней трубы.
Среда, нагретая в колонне до необходимой для стерилизации температуры (~130 оС), поступает в специальный аппарат, где она выдерживается определенное время при температуре 125-130 оС. Время выдержки зависит от состава среды и длится 5-10 минут. Отсюда стерильная среда поступает в змеевиковый холодильник, охлаждается до 30-35 оС (на выходе) и поступает в ферментатор.
Непрерывный метод стерилизации имеет ряд преимуществ: возможность автоматического регулирования процесса, быстрый и равномерный нагрев среды, обеспечение более полной стерильности среды и др.
Подготовка посевного материала
Подготовка посевного материала - одна из ответственейших операций в цикле биотехнологического способа получения антибиотиков. От количества и качества посевного материала зависит как развитие культуры в ферментаторе, так и биосинтез антибиотика. Продуцент обычно выращивают на богатых по составу натуральных средах, способных обеспечить наивысшую физиологическую активность микроорганизмов. Подготовка посевного материала - процесс многоступенчатый (рис. 5.5).
 Рис. 5.5. Схема многоступенчатого приготовления посевного материала А - выращивание во флаконах, Б - в колбах на качалках: 1 - законсервированный исходный материал; 2 - споровая генерация на косом агаре в пробирке; 3 - II споровая генерация на твердой среде в сосуде; 3 а и 3б - I и III генерации на жидкой среде в колбе; 4 - ферментатор предварительного ино- кулирования; 5 - ферментатор инокулирования; 6 - основной ферментатор
Рис. 5.5. Схема многоступенчатого приготовления посевного материала А - выращивание во флаконах, Б - в колбах на качалках: 1 - законсервированный исходный материал; 2 - споровая генерация на косом агаре в пробирке; 3 - II споровая генерация на твердой среде в сосуде; 3 а и 3б - I и III генерации на жидкой среде в колбе; 4 - ферментатор предварительного ино- кулирования; 5 - ферментатор инокулирования; 6 - основной ферментатор
|
Микроорганизм предварительно выращивают на агаризованной среде в пробирке (1, 2), затем из пробирки делают высев в колбы с жидкой питательной средой и проводят две генерации при глубинном выращивании на качалках в течение двух-трех суток для каждой генерации (3а и 3б). Из второй генерации культуры в колбе делают посев в небольшой (10 л) инокулятор 4, после чего хорошо развившуюся культуру переносят в более крупный инокулятор 5 (100-500 л), откуда и делают посев в основной ферментатор 6. Для посева в основной ферментатор используют от 5 до 10 % посевного материала (инокулята).
Развитие продуцента антибиотика в ферментаторах
Развитие микроорганизма в ферментаторах проходит при строгом контроле всех его стадий и очень точном выполнении регламента условий развития. Большое внимание уделяют поддержанию заданной температуры культивирования, активной кислотности среды (рН), степени аэрации и скорости работы мешалки. В процессе развития организма осуществляют биологический контроль, учитывают потребление организмом основных питательных компонентов субстрата (источника углерода, азота, фосфора), внимательно следят за образованием антибиотика. В последнее время все чаще биологический контроль проводят с помощью ЭВМ.
Большое внимание при развитии продуцента в ферментаторах обращают на процесс пеногашения. При продувании воздуха через культуру микроорганизма образуется обильная пена, которая существенно нарушает процесс развития продуцента антибиотика в ферментаторе. Появление большого количества пены обусловлено белковыми веществами, находящимися в среде, и ее высокой вязкостью, что связано с обильным накоплением биомассы.
Для борьбы с пеной в ферментаторах используют поверхностно- активные вещества: растительные масла (соевое, подсолнечное), животный жир (лярд, кашалотовый жир), а иногда минеральные масла (вазелиновое, парафиновое), спирты и высшие жирные кислоты. Нередко в качестве пеногасителей используют специально синтезированные вещества (силиконы, диазобутананкарбамил и др.).
Многие вещества (масла, жиры, спирты и др.), используемые в качестве пеногасителей, потребляются продуцентами антибиотиков как дополнительные источники углеродного питания. При этом часто наблюдается повышение выхода антибиотика. Однако внесение пенога- сителя может снижать скорость растворения кислорода, что, в свою очередь, отрицательно сказывается на развитии микроорганизма и его биосинтетической активности.
Иногда используются механические способы пеногашения (отсасывание пены через специальные трубы, разрушение пузырьков пены сильными струями жидкости, пара или газа).
Общая схема производства антибиотиков до стадии выделения и химической очистки представлена на рис. 5.6.
Предварительная обработка культуральной жидкости, выделение и химическая очистка антибиотиков
В процессе развития микроорганизмов образуемые им антибиотики в большинстве случаев почти полностью выделяются из клеток в окружающую среду. Однако в ряде случаев в культуральную жидкость попадает лишь часть антибиотика, а другая часть сохраняется внутри клеток.
У ряда продуцентов антибиотик почти полностью содержится в клетках организма. В зависимости от того, где антибиотическое вещество сосредоточено, применяют соответствующие методы его извлечения. Так, если антибиотик находится в культуральной жидкости, его выделяют методами экстракции, используя для этого растворители, не смешивающиеся с жидкой фазой, осаждают в виде нерастворимого соединения или сорбируют ионообменными смолами. Если антибиотик содержится в культуральной жидкости и в клетках продуцента, то сначала антибиотик переводят в фазу, из которой наиболее целесообразно его изолировать. Например, антибиотик, содержащийся в культуральной жидкости, и клетки с антибиотическим веществом переводят в осадок, из которого антибиотик экстрагируют.
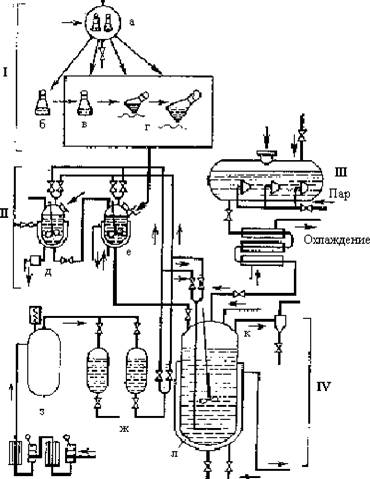 и
Рис. 5.6. Схема производства антибиотиков: I - приготовление посевного материала; II - инокуляторы для наращивания посевного материала; III - стерилизатор среды для большого ферментатора; IV - установка для биосинтеза антибиотика; а - стерилизация среды в колбах; б - охлаждение и посев культуры продуцента в колбу; в - рост культуры в покое; г - рост культуры в качалке; д - инокулятор со стерильной средой; е - инокулятор со средой, засеянной культурой продуцента; ж - фильтры и компрессор; з - резервуар со сжатым воздухом; и - нагрев воздуха; к - ферментатор; л - рубашка для охлаждения
ферментатора
и
Рис. 5.6. Схема производства антибиотиков: I - приготовление посевного материала; II - инокуляторы для наращивания посевного материала; III - стерилизатор среды для большого ферментатора; IV - установка для биосинтеза антибиотика; а - стерилизация среды в колбах; б - охлаждение и посев культуры продуцента в колбу; в - рост культуры в покое; г - рост культуры в качалке; д - инокулятор со стерильной средой; е - инокулятор со средой, засеянной культурой продуцента; ж - фильтры и компрессор; з - резервуар со сжатым воздухом; и - нагрев воздуха; к - ферментатор; л - рубашка для охлаждения
ферментатора
|
Отделение нативного раствора от биомассы и взвешенных частиц проводят методами фильтрации или центрифугирования.
Цель химической очистки - извлечение антибиотика из нативной жидкости или из клеток продуцента, его концентрация и освобождение (собственно, очистка) от сопутствующих примесей и в конечном счете получение высокоочищенного препарата, пригодного для соответствующего применения.
В ряде случаев антибиотические вещества под влиянием жестких внешних факторов (повышенной температуры, высокой кислотности или щелочности и др.) теряют свои свойства, инактивируются. Поэтому при их выделении и очистке необходимо соблюдать максимум осторожности.
Основные методы очистки антибиотиков следующие: экстракция, ионообменная сорбция и осаждение.
Сушка, контроль и расфасовка препарата
После выделения и химической очистки антибиотика его необходимо высушить, т. е. удалить из препарата свободную и связанную воду. Поскольку большинство антибиотиков в той или иной степени термолабильны, для их высушивания применяют методы, не приводящие к потере биологической активности, не изменяющие цвета препарата. На современном этапе промышленного получения антибиотиков используют следующие методы обезвоживания. Это:
• Лиофильная сушка антибиотиков - широко распространенный метод, он проводится при сравнительно низких температурах (-8 - - 12 оС).
• Высушивание с применением распылительной сушилки - прогрессивный метод при работе с большими количествами антибиотика, раствор антибиотика пневматически распыляется до мельчайших капель в камере с потоком нагретого воздуха. Процесс высушивания антибиотиков занимает несколько секунд, при этом даже термолабильные препараты не меняют свойств.
• Метод взвешенного слоя (или сушка в вакуум-сушильных шкафах) применяется для высушивания зернистых и пастообразных антибиотических препаратов.
Контроль препарата. Готовый антибиотик подвергается тщательному контролю: биологическому и фармакологическому.
При биологическом контроле ставится задача выяснения стерильности готового препарата. Для этого обычно используют два метода.
Первый связан с инактивацией антибиотика и высевом его в соответствующую питательную среду. Например, биологический контроль бензилпенициллина и полусинтетических препаратов, полученных на его основе, проводится следующим образом. В пробирки, содержащие тиогликолевую среду, вносят фермент пенициллазу в количестве, способном полностью инактивировать пенициллин. Пробирки с пеницилла- зой выдерживают двое-трое суток при температуре 37 оС для контроля стерильности фермента, затем в них вносят раствор пенициллина. Пробирки разделяют на две группы: одну выдерживают при 37 оС, а другую - при 24 оС в течение пяти суток. Ведут ежедневное наблюдение за возможным развитием микроорганизмов.
Второй метод выяснения стерильности антибиотиков определяется тем, что для большинства этих соединений не имеется инактиваторов их биологической активности. Поэтому у изучаемых препаратов выявляют устойчивые к ним формы микроорганизмов, а также определяют возможное присутствие чувствительной микрофлоры. Для определения возможного присутствия в таких препаратах чувствительной к ним микрофлоры раствор антибиотика пропускают через мембранные фильтры с диаметром пор не более 0,75 мк.
Фармакологический контроль. К антибиотическим веществам, используемых в медицинской практике, в соответствии с Государственной Фармакопеей предъявляются очень строгие требования. Каждый новый лекарственный препарат, прежде чем он будет разрешен к практическому применению, должен пройти всесторонние испытания на токсичность, пирогенность и другие свойства, жизненно важные для организма. Препарат изучают на разных видах животных в отношении его острой и хронической токсичности (влияние на кровь, ЦНС, дыхание и т. д.). Показатели острой токсичности - один из критериев качества антибиотического вещества. Устанавливают максимально переносимую дозу (МПД) антибиотика; дозу, вызывающую гибель 50 % подопытных животных (LD50) и смертельную дозу (LD100). Только после всестороннего и тщательного изучения препарата он может быть рекомендован к практическому применению.
Расфасовка и упаковка антибиотика - завершающий этап работы. Расфасованный и упакованный антибиотик с указанием показателя биологической активности, даты выпуска и срока годности поступает в продажу.
Обобщая весь многостадийный и многоступенчатый процесс получения антибиотика, можно отметить, что он включает в себя четыре основные стадии:
I стадия - получение соответствующего штамма, продуцента ан- тибио-тика, пригодного для промышленного производства;
II стадия непосредственно связана с процессом биосинтеза антибиотика;
III стадия - это процессы выделения и очистки образовавшегося в ходе биосинтеза антибиотика;
IV стадия включает в себя операции, связанные с концентрацией антибиотика, его стабилизацией и получением готового продукта.
Биотехнологический процесс получения антибиотиков можно представить в виде следующей схемы (см. рис. 5.7).
Производство пенициллинов
В 1871 г. В.А. Манасеиным было установлено, что зеленая плесень Penicillium glaucum при своем росте уничтожает бактерии, попадающие в культуральную среду. Это свойство Penicillium было тогда же использовано врачом А. Г. Полотебневым, применившим смоченные этой плесенью повязки при лечении гнойных ран и язв.
Выдающееся открытие русских ученых не получило широкой известности, и в 1928 г. англичанин Александр Флеминг вторично обнаружил способность плесневого грибка Penicillium угнетать рост микроорганизмов. Было показано, что вызываемая плесенью гибель микробов обусловлена образованием неизвестного органического вещества, названного пенициллином.
Однако выделение пенициллина в чистом виде в то же время осуществлено не было, так как он оказался веществом очень лабильным, а применявшиеся методы очистки были несовершенны.
В годы Второй мировой войны огромная практическая потребность в эффективных антибактериальных препаратах привлекла к пенициллину внимание широкого круга специалистов, и примерно с 1939 г. начался период интенсивных исследований. Благодаря этому в относительно короткий срок (3-5 лет) англичанами Х. Флори и А. Чэттеном были разработаны способы промышленного получения и очистки пенициллина, изучены его лечебные свойства и методы клинического применения, а также установлена его химическая структура.
К пенициллинам относится группа близких по химическим свойствам соединений, содержащих в своей структуре b-лактамное и тиазо- лидиновые кольца:

|
R может иметь различные значения, в зависимости от типа пенициллина. Например, при R = -CH2C6H5 - это бензилпенициллин; R = - СН2-О-С6Н5 - это феноксиметилпенициллин и т. д. Наличие карбоксильной группы придает молекуле пенициллина сильные кислотные свойства, поэтому пенициллин легко образует соли со щелочами (Na,
K), а также с органическими основаниями, например с дибензилэтилен- диамином (препарат - бициллин).
Для практических целей медицины пенициллин получают в промышленности путем биосинтеза. Процесс биосинтеза складывается из следующих стадий: 1) выращивания посевного материала (микроорганизмов) в аппаратах малой емкости - инокуляторах; 2) выращивания посевного материала в больших посевных аппаратах; 3) процесса ферментации; 4) выделения антибиотика из культуральной жидкости и его очистки.
Важное значение имеет также селекционный подбор высокопроизводительных штаммов плесени, подготовка и стерилизация питательной среды и аппаратуры.
Очень важное значение для высокого выхода пенициллина имеет питательная среда, примерный состав которой (в %) следующий:
| Кукурузный настой - 3 (по объему) | Сульфат цинка - следы |
| Лактоза (или глюкоза) - 2 (по весу) | Карбонат кальция - 0,25 |
| Нитрат натрия - 0,6 | Магний сернокислый гептагидрат - 0,05 |
| Калий фосфорнокислый (одноза- мещенный) - 0,15 | Вода ~90 |
| Вместо какурузного настоя успешно применяется мука из хлопковых семян или мясные гидролизаты. |
Приготовленную питательную среду подвергают стерилизации. Процесс ведут в колоннах непрерывного действия. Далее питательная среда поступает в аппарат-выдерживатель, где охлаждается в течение определенного времени до температуры 23-25 оС.
Первая стадия процесса - выращивание стандартной колонии штаммов плесени Penicillium chrysogenum - проводится в инокуляторах на питательной среде, где процесс идет ~30 часов. Подготовленный инокулят передают в посевной аппарат, объем которого ~ в 10 раз больше объема инокулятора. В посевном аппарате находится также стерилизованная питательная среда. Процесс роста здесь идет ~15-20 часов, и далее посевной материал передается на ферментацию в большие реакторы - ферментаторы объемом до 100 м на питательную среду. Процесс ферментации идет ~70 часов при температуре 23-24 оС, рН среды 6-6,5 и постоянной аэрации воздуха - 1 л воздуха/1 литр питательной среды/1 мин по всему объему ферментатора.
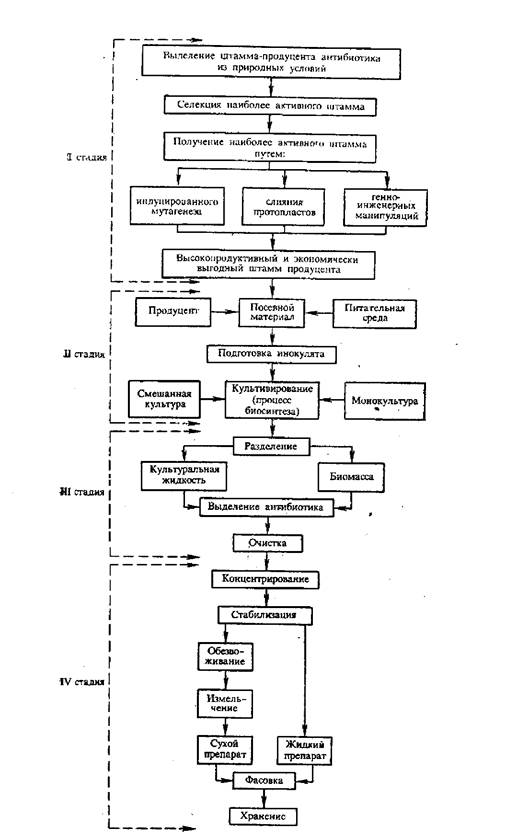 Рис. 5.7. Схема производства антибиотиков в процессе микробного
синтеза
Рис. 5.7. Схема производства антибиотиков в процессе микробного
синтеза
|
Основная задача этого процесса - создание оптимальных условий для развития продуцента и накопления антибиотика. Биосинтез антибиотика - двухфазный процесс. В течение первой фазы происходит быстрый рост и размножение мицелия или бактериальных клеток. Куль- туральная жидкость в этот период богата углеводами, азотом и неорганическим фосфором. Продукты обмена веществ микроорганизмов, в том числе и антибиотики, находятся в малых количествах.
Вторая фаза начинается с момента замедления роста культуры. Протекает она в культуральной жидкости, обогащенной продуктом жизнедеятельности организма с небольшим количеством углеводов и фосфора. В начале этой фазы мицелий обладает максимальной способностью к синтезу антибиотика. Фазы отличаются характером и интенсивностью биохимических реакций. С учетом этих различий подбирают условия, благоприятные для первой и второй фаз развития продуцента.
Для увеличения выхода антибиотика в питательную среду вводят «предшественники», т. е. химические вещества, способствующие целенаправленному синтезу антибиотика. Так, в питательную среду при биосинтезе пенициллина вводят «предшественник» фенилацетамид - это увеличивает выход антибиотика более чем в 2 раза.
По окончании процесса ферментации культуральную массу передают на процесс выделения антибиотика.
Большинство продуцентов при биосинтезе выделяют антибиотик в водную фазу, поэтому процесс выделения антибиотика начинается с разделения твердой и жидкой фаз.
Твердая фаза, кроме массы мицелия, содержит значительное количество коллоидных примесей, затрудняющих фильтрование, поэтому культуральную массу предварительно подвергают различным типам коагуляции (электролитической, тепловой, кислотной и т. д.). Наиболее эффективным методом коагуляции культуральной массы является ее обработка флокулянтами (высокомолекулярными полиэлектролитами), например, поли-(4-винил)-Ы-бензилтриметиламмонийхлоридом.
Оставшийся от фильтрации мицелия водный раствор антибиотика направляют на химическую очистку и выделение.
Таким образом, водный раствор пенициллина направляют после фильтрации на экстракцию бутилацетатом при рН водной среды, равной 2. При таком значении кислотности среды подавляет кислотная ионизация пенициллина в водной фазе и он переходит в органическую фазу (в бутилацетат). Реэкстракцию пенициллина из бутилацетата проводят слабыми растворами щелочей.
Широко применяются сорбционные методы выделения и очистки антибиотиков. В качестве сорбентов широко используются синтетические ионообменные смолы.
Сушат пенициллины методом сублимации или распыления.
Угроза резистентности
Успехи применения бензилпенициллина в лечении болезней, вызванных различными бактериями, были поистине сенсационными. Чувствительными к нему оказались и стафилококки, являющиеся возбудителями очень серьезных заболеваний. Статистические данные показывают, что в 1944 г. число инфекционных больных, вылеченных бензил- пенициллином, было около 99,8 %, однако, уже в 1956 г. этот процент снизился до 65 %, особенно большой процент инфицированных больных, не поддававшихся лечению бензилпенициллином, наблюдался среди работников предприятий, производящих антибиотики, и работников хирургических клиник, широко использующих антибиотики для лечения больных.
Почему же именно эти заведения стали рассадниками болезнетворных организмов, устойчивых к действию пенициллина? Уже со времени первого применения пенициллина стало известно, что некоторые стафилококки невосприимчивы к нему. Чувствительные к пенициллину штаммы стафилококков погибают при лечении, остаются резистентные стафилококки, которые начинают размножаться и заполнять опустевшую нишу. И, таким образом, применение пенициллина для лечения заболеваний, вызванных резистентными формами стафилококка, не приведет к положительному результату.
Каким же путем избегают гибели стафилококки, резистентные к пенициллину? Было установлено, что они способны обезвредить молекулу пенициллина, изменив его структуру в самом слабом месте. Устойчивые стафилококки вырабатывают фермент, который может разрушить молекулу пенициллина при добавлении к ней молекулы воды. При этом процессе (гидролизе) образуется соединение, безвредное для микробов.
Фермент, способствующий реакции «обезвреживания», называется пенициллиназой. Его возникновение вызывается присутствием в среде пенициллина. С 1969 г. стала известна и химическая структура пени- циллиназы, вырабатываемой стафилококками. В построении ее молекулы участвуют 257 структурных единиц двадцати аминокислот, соединенных в различной последовательности.
Другие бактерии образуют ферменты (ацилазы), которые разрывают связь между основным ядром молекулы бензилпеницилина и ее боковой ацильной группой, образуя биологически неактивную 6- аминопеницилановую кислоту
Ацилаза

| Пенициллаза |
| ■c |
| CO^-NH—C—COOH |
R—CO—NH—CH— ^H V^CH3
Второе расщепление ученые стали использовать для своих целей как возможность изменить молекулу пенициллина таким образом, чтобы ацилаза не смогла подвергнуть ее гидролизу. Таким способом были получены новые полусинтетические пенициллины.
Полусинтетический способ получения пенициллинов
В настоящее время большое значение имеет так называемый полусинтетический (биологический + химический) способ получения аналогов природного пенициллина, обладающих рядом ценных свойств. Исходным продуктом в синтезе служит 6-аминопенициллановая кислота (6-АПК)
H2^CH—CH r-CH3
/С------ NH—C—COOH
O
6-аминопенициллановая кислота Кислоту получают в результате биосинтеза, при развитии штамма плесени Penicillium chrysogenum, в специфических условиях его культивирования (при отсутствии предшественников в среде) или чаще путем ферментативного дезацилирования бензилпенициллина с участием пе- нициллинацилазы. При этом образуется 6-АПК и фенилуксусная кислота.
Ацилированием аминогруппы 6-АПК получен ряд новых полусинтетических антибиотиков, которые кислотоустойчивы в желудке, не подвергаются деструкции в организме пенициллиназой, обладают более широким спектром действия:
/SwCH3 O
| "с * ■ ■ Jc—Nh—с—cooh с1 O 6-АПК |
| / |

H2^c^CH Vv-ch3 + т-R
/SwCH3
R -C- NH CH PH V^CH3 + HCl
O ^C------------- NH—С COOH
новые антибиотики
В табл. 5.1 приведены наиболее распространенные полусинтетические пенициллины.
Химический синтез природного бензилпенициллина был проведен в 1957 г. Дж. Шееном с сотрудниками, однако он был многостадиен, давал низкий выход бензилпенициллина и поэтому не нашел практического применения.
Таблица 5.1
Полусинтетические пенициллины
| Медицинское название антибиотика | R | |
| Кислотоустойчивые препараты | ||
| Тропициллин | О | /O —СИ — C2H5 |
| Фенбициллин | f^yO СИ u 6 | |
| Пенициллиназоустойчивые препараты | ||
| Метициллин | СИз уСИ2- "-ЧэСНз | |
| Оксациллин | Сг | С — С — N С —СН3 ^ 3 |
| Ампициллин | с | Тснз |
Получение цефалоспоринов
Цефалоспорины относятся к группе b-лактамных антибиотиков, близких по структуре к пенициллину. Основной продуцент этого антибиотика - гриб Cepholosporium acremonium:
R-COH^^/S
^^V^CHOCOCH
COOH
Цефалоспорин С
Цефалоспорин подавляет развитие грамположительных и грамот- рицательных бактерий, но антибиотическая активность гораздо ниже, чем у пенициллина. Структура b-лактамного кольца его также неустойчива, и гидролизу ется ферментом цефалоспориназой.
Полусинтетические аналоги цефалоспорина
В последнее время методом смешанного (биологического и химического) синтеза получено большое число аналогов цефалоспорина. Многие из этих соединений имеют важное практическое значение.
Основой полусинтеза цефалоспоринов служит 7-амино- цефалоспорановая кислота, которая получается в результате отщепления ацильного остатка от цефалоспорина С под действием фермента ацилазы. Модификация основного ядра цефалоспорина может происходить с двух сторон молекулы:
^^^^СНзОСОСНз СООН
7-аминоцефалоспорановая кислота
Химическим или биотехнологическим (ферментативным) путем можно отщепить правую ацетоксигруппу (-ОСОСН3) 7- аминоцефалоспорановой кислоты с образованием 7- аминодеацетоксицефалоспорановой кислоты и на ее основе синтезировать полусинтетические антибиотики, широко применяемые в медицинской практике.
Общая формула полусинтетических цефалоспоринов R - NH^^Sv
СООН
В табл. 5.2 приведены некоторые медицинские препараты, полученные на основе полусинтетических цефалоспоринов.
Таблица 5.2
| Медицинское название антибиотика | Ri | R2 |
| Цефалоридин | /S\Z СН2СО- О 2 | |
| Цефокситин | ^Y СН2СО- | -СН2ОС- NH2 |
Окончание табл. 5.2
|
Модификация молекулы цефалоспорина приводит к существенным изменениям антимикробных свойств: расширению спектра антимикробного действия, увеличению устойчивости антибиотиков к лакта- мазам, повышению липофильных свойств веществ, что дает возможность использовать их в таблетках.
Получение стрептомицина
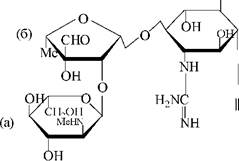
Ярко выраженной способностью вырабатывать антибиотические вещества обладают, помимо плесеней и микробов, также и лучистые грибки - актиномицеты, обычно обитающие в почве. Сравнительно быстрая гибель большинства патогенных микробов при попадании в почву тесно связана с явлением антагонизма актиномицетов и бактерий. Изучение этого явления привело к открытию в 1943 г. С. Ваксманом второго после пенициллина антибиотика - стрептомицина, устойчивого не только к грамположительным, но и к грамотрицательным, и кислотостойким бактериям:
|
| OH |
| (в) |
| NH |
| CNH2 NH |
| Стрептомицин |
В этом смысле он превосходит пенициллин, который почти не активен к последним двум группам возбудителей инфекции. Особенно важным свойством стрептомицина является его высокая активность к возбудителю туберкулеза.
В своей структуре стрептомицин содержит (а) N-метил-Б- глюкозамин, (б) - стрептозу и (в) - стрептидин и является сильным органическим основанием. В практике применяют его соли с кислотами (соляной, серной и др.)
При культивировании стрептомицина в качестве источника энергии требуется быстро метаболизируемый сахар (например, глюкоза), который вводят в начале процесса. Однако скорость его ассимиляции должна быть строго ограничена количеством присутствующего азота и фосфата, что в противном случае приводит к чрезмерному росту мицелия и снижению выхода антибиотика. На практике азот вводится в виде сложных соединений (фильтрат барды и остатки масличного семени), которые в течение длительного процесса ферментации медленно разлагаются, выделяя аммиачный азот, рН среды 7,0-8,0, температура ферментации ~28,5 оС. На стрептомицин не действует ни пенницилаза, ни большинство микроорганизмов; если на более поздних стадиях процесса происходит инфицирование культуры, то образовавшийся стрептомицин не разрушается.
Типичные промышленные среды представляют смеси 2,5 %-й глюкозы, 4 %-й соевой муки с низким содержанием масла, 0,5 %-й барды и 0,25 %-й поваренной соли; в некоторых случаях добавляют сухие дрожжи, мясные экстракты и кукурузный экстракт. В процессе ферментации могут использоваться масла и жирные кислоты (в качестве питательных компонентов либо в качестве пеногасителей). Процесс ферментации развивается так же, как и в случае производства пенициллина, причем образование стрептомицина в течение первых трех дней не происходит. За 6 дней концентрация стрептомицина достигает конечной величины - 0,8 %.
Поскольку мицелий получается гораздо более мелкий, его нельзя собрать на волокнистом фильтре, поэтому для осветления субстрата используют кизельгур, в результате чего отфильтрованная масса делается пригодной для скармливания скоту. Субстрат разделяют на ионообменной колонне.
Получение тетрациклинов
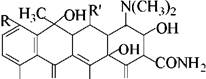
В 1948 г. из почвы был выделен новый вид актиномицета - Strep- tomyces aureofaciens, образующий антибиотики - хлортетрациклин, тетрациклин и другие вещества:
 ОН О ОН О
1) R = R' = И - тетрациклин
2) R = Н, R' = ОН - окситетрациклин
3) R = Cl, R' = Н - хлортетрациклин и т.д.
ОН О ОН О
1) R = R' = И - тетрациклин
2) R = Н, R' = ОН - окситетрациклин
3) R = Cl, R' = Н - хлортетрациклин и т.д.
|
Как было найдено, эти антибиотики обладают широким антибиотическим действием в отношении грамположительных и грамотрица- тельных бактерий, риккетсий, спирохет, хламидий и т. д. Их применяют в сельском хозяйстве как стимуляторы роста животных и птиц.
Хлортетрациклин был первым из выделенных тетрациклинов. В зависимости от свойств штамма в качестве источника энергии могут быть использованы различные углеводы, однако для промышленного производства представляют интерес лишь сахароза, крахмал и глюкоза. Максимальные выходы антибиотика достигаются в результате ограничения содержания неорганического азота в среде и заменой его сложными веществами биологического происхождения (мукой масличных семян, арахисом, копрой - ядром кокосового ореха). В среду во многих случаях добавляют кровяную муку, рыбную муку и гидролизованный казеин. В ограниченных концентрациях используют кукурузный экстракт и барду при определенном содержании фосфатов. Содержание фосфатов является важным фактором, поскольку пока весь неорганический фосфат полностью не будет преобразован в нуклеиновые кислоты и другие продукты обмена, образование тетрациклина не происходит. Также в среде необходимо присутствие катионов микроэлементов (Со, Си, Zn, Mn, Fe). Примерный состав питательных сред: крахмал (зерно в перемолотом и набухшем состоянии) 2-5 %, сахароза (в виде сахара или свекольной патоки) 1-3 %, мука из масличного семени (отходы с низким содержанием жиров, арахис или соя) 1-3 %, мясные отходы (кровяная или мясная мука) 0,2-0,5 %, кукурузный экстракт 0,2- 1,0 %, аммониевые соли 0,1-0,5 %, известь 0,5 %, поваренная соль 0,1-0,5 %, соли микроэлементов.
Для ферментации желательно применять ферментаторы, изготовленные из нержавеющей стали или другого стойкого материала. В течение четырех дней, пока длится процесс, среда должна аэрироваться. Окончательное значение выхода продукта приближается к 1 %. Препарат может быть осажден добавлением извести до рН 8,8. Затем он отфильтровывается на фильтр-прессе, экстрагируется разбавленной кислотой и очищается посредством фракционного осаждения: после перекристаллизации можно получить продукт, достигающий 98 % чистоты.
Окситетрациклин был впервые изготовлен в 1950 г. при культивировании актиномицета Streptomyces rimosus. Среда и условия ферментации подобны используемым при производстве хлортетрациклина, за тем исключением, что в качестве источника азота могут быть использованы нитраты и кукурузный экстракт.
Окситетрациклин образует нерастворимый комплекс с солями четвертичного аммониевого основания, и этот комплекс может быть легко отделен от субстрата, после чего его размягчают соляной кислотой и затем кристаллизуют в виде соли уксусной кислоты. Как и другие тет- рациклины, этот препарат выпускается главным образом в виде таблеток или суспензии.
Тетрациклин был получен после хлортетрациклина и окситетра- циклина, причем почти одновременно как путем направленной ферментации с помощью отобранных штаммов Streptomyces aureofaciens в условиях низкого содержания хлоридов в питательной среде, так и путем каталитического восстановления хлортетрациклина.
В методе направленной ферментации используется ряд организмов, в том числе и Streptomyces vicidifaciens, при этом полученный штамм в адекватной среде может обеспечить большие выходы тетрациклина или равные количества хлортетрациклина и тетрациклина пропорционально количеству присутствующих ионов хлора. В случаях, когда необходимо избежать образования хлортетрациклина, содержание хлорида в среде не должно превышать 17 ч./млн. Если необходимо использовать в качестве основных компонентов субстрата сложные биологические вещества, то в условиях промышленного производства для контроля уровня хлоридов имеются два способа:
1) удалять большую часть хлорида, пропуская компоненты, такие, как сахар-сырец и кукурузный экстракт через ионообменные смолы. Этот метод вполне эффективен, если применяется к разбавленным растворам;
2) вводить в среду вещества, замедляющие утилизацию хлорида, например, бромиды. Оказалось, что при концентрациях от 10 до 350 ч./млн., ионы брома практически подавляют образование хлортетрациклина, даже в присутствии ионов хлора в концентрациях 1500 ч./млн. На практике применяют бромистый натрий (5 %).
Получение антибиотиков-макролидов
Большую группу антибиотиков (эритромицин, олеандомицин и др.), содержащих в своей структуре макроциклический лактонный фрагмент и продуцируемых различными штаммами Streptomyces, составляют так называемые макролиды. Наиболее известным представителем этой группы является эритромицин, который по спектру антибактериального действия близок к пенициллину и применяется для лечения больных с повышенной чувствительностью к пенициллину и тетрациклину.

|
| o |
| ch д |
| ch |
| h |
| h3c-4 | ^ч^ч^си |
| гсит | |
| нзсу | j снз /=о |
| OH o | |
| сА | I си |
| снз сиз СН3 |
| oo |
| Эритромицин |
| з |
Культивирование продуцента эритромицина длится 150 часов при рН~7 на среде, приготовленной на основе крахмала, соевой муки, масла, кукурузного экстракта, сухих дрожжей и извести. Культуральную жидкость фильтруют на кизельгуре, и антибиотик экстрагируют с помощью амилацетата. Обычно фильтрат культуры и растворитель пропускают через установленный в системе смеситель, а затем через обычную центрифугу. Антибиотик можно разбавить буферным раствором, осадить ацетоном и хлористым натрием, и, наконец, кристаллизовать его из ацетонового раствора.
Широкое и успешное использование антибиотиков в медицине привело к их использованию и в других областях, в том числе:
- в ветеринарии (с теми же целями, что и в медицине);
- для борьбы с некоторыми болезнями растений бактериального и грибкового происхождения;
- в качестве добавки к кормам животных, так как они ускоряют рост и увеличивают степень превращения кормов в мясо;
- в качестве консервантов скоропортящихся продуктов;
- для подавления бактериальной флоры при осуществлении различных процессов при производстве вакцин.
Наука об антибиотиках продолжает быстро развиваться. С одной стороны, продолжаются поиски новых, еще более эффективных препаратов биотехнологии, в том числе с иммуностимулирующим, противоопухолевым, противовирусным действием, с другой стороны, расширяются работы по химическому синтезу производных этих веществ и химической модификации природных антибиотиков.

| ch |
| (снз)2к |
Продолжаются работы по созданию новых и совершенствованию действующих процессов биотехнологии, предусматривающих создание экологически чистых безотходных технологий.
Развитие исследований в этом направлении и внедрение их в практику является одним из перспективнейших разделов естествознания.
5.3. ПРОИЗВОДСТВО БЕЛКОВ ОДНОКЛЕТОЧНЫХ И МНОГОКЛЕТОЧНЫХ
ОРГАНИЗМОВ
Крупномасштабное культивирование микроорганизмов как прямой источник белка для питания человека и животных рассматривалось в качестве способа решения проблемы нехватки пищи в Германии уже во время Первой мировой войны. Были разработаны технологические процессы культивирования пивных дрожжей, которые после обработки и высушивания добавляли в супы и колбасы. Во время Второй мировой войны эти процессы уже были хорошо отработаны.
Выражение «белки одноклеточных организмов» возникло в 60-е гг. применительно к бактериальной биомассе (преимущественно дрожжей), которая используется в качестве пищевого компонента животных и человека. Особенно привлекательным является тот факт, что питательной средой при культивировании бактерий зачастую являются отходы сельского хозяйства: жмых сахарной свеклы в производстве сахара, подсолнечный жмых при получении растительного масла, молочная сыворотка в производстве сыра, древесная стружка и опилки и т. п.
Интерес к этой проблеме вспыхнул после публикации результатов исследований, показывающих возможность производства таких белковых концентратов на основе углеводородов. Нефтяные компании финансировали развитие этих исследований не только по причине использования углеводородов, но и в связи с благоприятными результатами пищевых тестов и перспективами сбыта.
Первая крупномасштабная фабрика белкового концентрата была разработана совместной фирмой «British Petroleum» (Великобритания) и «Италпротеин» (Италия) в 1975 г, ее производительность составляла 100000 т/год; сырьем были нормальные парафины. Этой проблемой занялась и Япония, были построены 8 заводов производительностью 1500 т белка/год. Однако интерес к производству белка одноклеточных организмов в 70-е гг. несколько снизился; отчасти из-за благоприятной сельскохозяйственной ситуации тех лет, но главным образом из-за несовершенства технологий, не удаляющих некоторые токсические вещества из конечного продукта.
В 80-е гг. германская фирма «Хехст», отличающаяся на рынке своими высокими технологиями, разработала процессы получения высококачественных белковых концентратов. В 80-е гг. одним из ведущих в мире производителем белков был СССР с его неисчерпаемой сырьевой базой. В Финляндии сооружена фабрика, использующая гриб Paecilomyces в сульфитных стоках бумажных комбинатов; мощность фабрики - 10000 т белка/год.
В странах ЕЭС производится белковых концентратов около 25 млн т в год. Эти цифры говорят о рентабельности предприятий. Корм для скота становится дорогим из-за ограничения земельных угодий и по ряду других причин. Белки одноклеточных организмов имеют огромные преимущества: высокую скорость воспроизводства, доступность сырьевых источников, решение проблем утилизации отходов многих предприятий и т. д. Кроме того, белки имеют постоянный и воспроизводимый состав, их легко витаминизировать, добавлять необходимые микроэлементы; их также легко изготовлять в виде гранул или таблеток, их хранение осуществляется намного легче, чем хранение растений или других кормов.
Тем не менее производители белка не рассматривают свою продукцию как заменитель белка в рационе животных: белковые концентраты служат добавками к кормам, удешевляя их и повышая их качество.
Следует отметить, однако, что производство белковых добавок развивается не столь быстро, как прогнозировалось в 60-70 гг. Дело в том, что в значительной степени ужесточились требования к безопасности технологий, которые должны учитывать результаты всех необходимых токсикологических и пищевых испытаний.
Особенно осторожными следует быть в вопросах применения белковых концентратов в питании человека. Однако их использование для решения проблемы питания населения земли не имеет альтернативы, поскольку прогнозы свидетельствуют о том, что прирост населения не соответствует приросту продуктов питания. Можно с уверенностью сказать, что освоение микроорганизмов в питании человека только начинается.
Микроорганизмы начали использовать в производстве белковых продуктов задолго до возникновения микробиологии. Достаточно упомянуть всевозможные разновидности сыра, а также продукты, получаемые путем ферментации соевых бобов. И в первом, и во втором случае питательной основой является белок. При выработке этих продуктов, при участии микробов, происходит глубокое изменение свойств белок- содержащего сырья. В результате получают пищевые продукты, которые можно дольше хранить (сыр) или удобнее потреблять (соевый творог). Микробы играют роль в производстве некоторых мясных продуктов, предназначенных для хранения. Так, при изготовлении некоторых сортов колбасы используется кислотное брожение, обычно при участии комплекса молочнокислых бактерий. Образовавшаяся кислота способствует сохранности продукта и вносит вклад в формирование его особого вкуса.
Этим, пожалуй, и ограничивается использование микроорганизмов в переработке белков. Возможности современной биотехнологии в этих производствах невелики, за исключением сыроделия. Другое дело - выращивание и сбор микробной массы, перерабатываемой в пищевые продукты: здесь биотехнология может проявить себя во всей полноте.
5.3.1. Производство белка одноклеточных организмов
По многим важным показателям биомасса микроорганизмов может обладать весьма высокой питательной ценностью. В немалой степени эта ценность определяется белками: у большинства видов они составляют значительную долю сухой массы клеток. На протяжении десятилетий активно обсуждаются и исследуются перспективы увеличения доли белка микроорганизмов в общем балансе производимого во всем мире белка.
Производство такого белка связано с крупномасштабным выращиванием определенных микроорганизмов, которые собирают и перерабатывают в пищевые продукты. Чтобы осуществить возможно более полное превращение субстрата в биомассу микробов, требуется многосторонний подход. Выращивание микробов в пищевых целях представляет интерес по двум причинам. Во-первых, они растут гораздо быстрее, чем растения и животные: время удвоения их численности измеряется часами. Это сокращает сроки, нужные для производства определенного количества пищи. Во-вторых, в зависимости от выращиваемых микроорганизмов в качестве субстратов могут использоваться разнообразные виды сырья. Что касается субстратов, то здесь можно идти по двум главным направлениям: перерабатывать низкокачественные бросовые продукты или ориентироваться на легкодоступные углеводы и получать за их счет микробную биомассу, содержащую высококачественный белок.
Получение микробного белка на метаноле
Основное преимущество этого субстрата - высокая чистота и отсутствие канцерогенных примесей, хорошая растворимость в воде, высокая летучесть, позволяющая легко удалять его остатки из готового продукта. Биомасса, полученная на метаноле, не содержит нежелательных примесей, что дает возможность исключить из технологической схемы стадии очистки.
Однако необходимо учитывать при проведении процесса и такие особенности метанола, как горючесть и возможность образования взрывоопасных смесей с воздухом.
В качестве продуцентов, использующих метанол в конструктивном обмене, были изучены как дрожжевые, так и бактериальные штаммы. Из дрожжей были рекомендованы в производство Candida boidinii, Hansenula polymorpha и Piehia pastoris, оптимальные условия для которых (температура 34-37 °C, рН 4,2-4,6) позволяют проводить процесс с экономическим коэффициентом усвоения субстрата до 0,40 при скорости протока в интервале 0,12-0,16 ч-1. Среди бактериальных культур применяется Methylomonas clara, Pseudomonas rosea и др., способные развиваться при температуре 32-34 °C, рН 6,0-6,4 с экономическим коэффициентом усвоения субстрата до 0,55 при скорости протока до 0,5 ч- 1.
Особенности процесса культивирования во многом обусловлены применяемым штаммом-продуцентом (дрожжи или бактерии) и условиями асептики. Ряд зарубежных фирм предлагает использовать дрожжевые штаммы и проводить выращивание в отсутствии строгой асептики. В этом случае технологический процесс протекает в ферментаторе эжекционного типа производительностью 75 т белка в сутки, а удельный расход метанола составляет 2,5 т/т белка.
При культивировании дрожжей в асептических условиях рекомендованы аппараты колонного или эрлифитного типа производительностью 75-100 т белка/сут при расходе метанола до 2,63 т/т белка. В том и другом случае процесс культивирования проводится одностадийно, без стадии «дозревания», с невысокой концентрацией субстрата (810 г/л).
В ряде стран в качестве продуцентов применяются бактериальные штаммы, процесс проводится в асептических условиях в ферментаторах эрлифитного или струйного типов производительностью 100-300 т/сут и расходом метанола до 2,3 т/т белка. Ферментация осуществляется одностадийно при невысоких концентрациях спирта (до 12 г/л), с высокой степенью утилизации метанола.
Наиболее перспективным по своей конструкции является струйный ферментатор Института технической химии (Германия). Ферментатор объемом 1000 м состоит из секций, расположенных одна над другой и соединенных между собой шахтными переливами. Ферментационная среда из нижней секции ферментатора по напорному трубопроводу подается центробежными циркуляционными насосами в верхние шахтные переливы, через которые проходит в низлежащую секцию, подсасывая при этом воздух из газовода. Таким образом, среда протекает из секции в секцию, постоянно подсасывая новые порции воздуха.
Падающие струи в шахтных переливах обеспечивают интенсивное аэрирование среды.
Питательная среда непрерывно подается в зону верхних шахтных переливов, а микробная суспензия отводится из выносных контуров. На стадии выделения для всех видов продуцентов предусмотрено отделение грануляции с целью получения готового продукта в гранулах.
Кормовые дрожжи, полученные на метаноле, имеют следующий состав (в %): сырой протеин 56-62; липиды 5-6; зола 7-11; влага 8-10; нуклеиновые кислоты 5-6. Бактериальная биомасса характеризуется следующим составом (в %): сырой протеин 70-74; липиды 7-9; зола 810; нуклеиновые кислоты 10-13; влажность 8-10.
Кроме метанола, в качестве высококачественного сырья используют этанол, который имеет малую токсичность, хорошую растворимость в воде, небольшое количество примесей.
В качестве микроорганизмов - продуцентов белка на этиловом спирте как единственном источнике углерода могут использоваться дрожжи (Candida utilis, Sacharomyces lambica, Hansenula anomala, Aci- netobacter calcoaceticus). Процесс культивирования проводят одностадийно в ферментаторах с высокими массообменными характеристиками при концентрации этанола не более 15 г/л.
Дрожжи, выращенные на этаноле, содержат (в %): сырого протеина - 60-62; липидов - 2-4; золы - 8-10; влаги - до 10.
Получение белковых веществ на углеводном сырье
Исторически одними из первых субстратов, используемых для получения кормовой биомассы, были гидролизаты растительных отходов, предгидрализаты и сульфитный щелок - отходы целлюлозно- бумажной промышленности. Интерес к углеводному сырью как основному возобновляемому источнику углерода значительно возрос еще и с экологической точки зрения, так как оно может служить основой для создания безотходной технологии переработки растительных продуктов.
В связи с тем, что гидролизаты представляют собой сложный субстрат, состоящий из смеси гексоз и пентоз, среди промышленных штаммов-продуцентов получили распространение виды дрожжей C. utilis, C. scottii и C. tropicalis, способные наряду с гексозами усваивать пентозы, а также переносить наличие фурфурола в среде.
Состав питательной среды, в случае культивирования на углеводородном сырье, значительно отличается от применяемого при выращивании микроорганизмов на углеводородном субстрате. В гидролиза- тах и сульфитных щелоках имеются в небольшом количестве практически все необходимые для роста дрожжей микроэлементы. Недостающие количества азота, фосфора и калия вводятся в виде общего раствора солей аммофоса, хлорида калия и сульфата аммония.
Ферментация осуществляется в эрлифтных аппаратах конструкции Лефрансуа-Марийе объемом 320 и 600 м. Процесс культивирования дрожжей осуществляется в непрерывном режиме при рН 4,2-4,6. Оптимальная температура - от 30 до 40 °С.
Кормовые дрожжи, полученные при культивировании на гидроли- затах растительного сырья и сульфитных щелоках, имеют следующий состав (в %): белок - 43-58; липиды - 2,3-3,0; углеводы - 11-23; зола - до 11; влажность - не более 10.
Одним из перспективных субстратов в производстве кормовой биомассы являются гидролизаты торфа, имеющие в своем составе большое количество легкоусвояемых моносахаров и органических кислот. Дополнительно в состав питательной среды вводятся лишь небольшие количества суперфосфата и хлорида калия. Источником азота служит аммиачная вода. По качеству кормовая биомасса, полученная на гидролизатах торфа, превосходит дрожжи, выращенные на отходах растительного сырья.
5.3.2. Производство грибного белка (микопротеина)
Микопротеин - это пищевой продукт, состоящий в основном из мицелия гриба. При его производстве используется штамм Fusarium graminearum, выделенный из почвы. Микопротеин производят сегодня на опытной установке методом непрерывного выращивания. В качестве субстрата используется глюкоза и другие питательные вещества, а источниками азота служат аммиак и аммонийные соли. После завершения стадии ферментации культуру подвергают термообработке для уменьшения содержания рибонуклеиновой кислоты, а затем отделяют мицелий методом вакуумного фильтрования.
Если сопоставить производство микопротеина с процессом синтеза белков животных, то выявится ряд его преимуществ. Помимо того, что здесь выше скорость роста, превращение субстрата в белок происходит несравненно эффективнее, чем при усвоении пищи домашними животными. Это отражено в табл. 5.3.
Нелишне напомнить, что корма для животных должны содержать некоторое количество белка (до 15-20 %), в зависимости от вида животных и способа их содержания. Положительным фактором является и волокнистое строение выращенной культуры; текстура массы мицелия близка к таковой у естественных продуктов, поэтому у продукта может быть имитирована текстура мяса, а за счет добавок - его вкус и цвет.
Плотность продукта зависит от длины гифов выращенного гриба, которая определяется скоростью роста.
Таблица. 5.3
Эффективность конверсии при образовании белка для различных
животных и Fusarium graminearum
|
После проведения всесторонних исследований питательной ценности и безвредности микопротеина Министерство сельского хозяйства, рыболовства и пищевых продуктов дало разрешение на его продажу в Англии. Содержание питательных веществ в нем указано в табл. 5.4.
Таблица 5.4
Средний состав микопротеина и сравнение его с составом говядины
|
| 5.3.3. Производство цианобактерий |
В 1521 г. испанец Бернал Диас дель Кастильо в своих записках упомянул о галетах под названием «текуитлатл», которые продавались на базаре в Мехико. Они были необыкновенного синего или зеленого цвета, очень вкусные и питательные. Оказалось, что они изготовлены из сине-зеленых водорослей озера Текскоко (неподалеку от Мехико). Пласты этих водорослей извлекали из озера, сушили слоями и изготовляли галеты. Озеро Текскоко примечательно тем, что вода в нем имеет сильно щелочную реакцию (вплоть до pH 11).
В настоящее время известно, что эти сине-зеленые водоросли представляют собой цианобактерии Spirulina platensis.
В 1964 г. бельгийский ботаник Леонар, участвуя в экспедиции через Сахару, обратил внимание на сине-зеленые лепешки, которые употребляли в пищу жители в районе озера Чад и прудов, его окружающих. По возвращении в Бельгию он проанализировал
Date: 2015-09-24; view: 18207; Нарушение авторских прав