
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задача 420
|
|
Определить э.д.с. элемента, у которого электродами являются две платиновые пластинки, опущенные в растворы SnCl2 и FeCl3. Составить схему гальванического элемента.
Решение:
В этом элементе по проводнику, соединяющему электроды, будет идти электрический ток в результате окислительно-восстановительной реакции:
SnCl2 + 2FeCl3 ® SnCl4 + 2FeCl2.
В подобных гальванических элементах электроды (Рt) не участвуют во взаимодействии, а являются лишь переносчиками электронов. Схему элемента для приведенной выше реакции можно представить следующим образом:
(-) Pt, Sn2+ ½Sn4+ ½½Fe3+ ½Fe2+ , Pt(+).
На аноде Sn2+ -2e ® Sn4+ j01= + 0,15В.
На катоде Fe3+ +e ® Fe2+ j02= + 0,771 В.
Sn2+ + 2Fe3+ ® Sn4+ + 2Fe2+.
Исходные и полученные в результате реакции ионы олова образуют окислительно-восстановительную пару Sn2+/Sn4+, которая является одним из полуэлементов. Вторым полуэлементом является окислительно-восстановительная пара Fe3+/Fe2+.
Разность потенциалов на границе между инертным электродом и раствором, содержащим окисленную и восстановленную формы вещества, называют окислительно-восстановительным потенциалом:
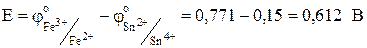 .
.
При выполнений заданий рекомендуется использовать методические указания [1].
Стандартные значения электродных потенциалов найти в табл. 4 приложения.
В задачах 392–420 определить электродвижущую силу элементов, написать уравнения реакций, за счет которых возникает разность потенциалов. Составить схемы элементов
| № задачи | 1-й полуэлемент | 2-й полуэлемент |
| Mg; MgSO4 (C1=0,1 моль/л) | Fe; FeSO4 (C2=0,01 моль/л) | |
| Cd; CdSO4 (C1=0,01 моль/л) | Cd; CdSO4 (C2=0,1 моль/л) | |
| Pt, H2; H2SO4 (C1=1 моль/л) | Ag; AgNO3 (C2=0,1 моль/л) | |
| Al; AlCl3 (C1=0,1 моль/л) | Pt, H2; HCl (C2=1 моль/л) | |
| Pb; Pb(NO3)2 (C1=0,01 моль/л) | Cu; Cu(NO3)2 (C2=1 моль/л) | |
| Fe; Fe(NO3)2 (C1=1 моль/л) | Pb; Pb(NO3)2 (C2=1 моль/л) | |
| Ag; AgNO3 (C1=0,1 моль/л) | Ag; AgNO3 (C2=1 моль/л) | |
| Zn; ZnSO4 (C1=0,01 моль/л) | Ni; NiSO4 (C2=0,01 моль/л) | |
| Ni; NiSO4 (C1=0,001 моль/л) | Cu; CuSO4 (C2=0,01 моль/л) | |
| Cd; CdCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=0,01 моль/л) | |
| Zn; ZnSO4 (C1=1 моль/л) | Pt, H2; H2SO4 (C2=1моль/л) | |
| Fe; FeCl2 (C1=0,1 моль/л) | Ag; AgCl (C2=0,01 моль/л) | |
| Fe; FeCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=1 моль/л) | |
| Mg; Mg(NO3)2 (C1=0,01 моль/л) | Pb; Pb(NO3)2 (C2=0,01моль/л) | |
| Cu; CuCrO4 (C1=0,01 моль/л) | Cu; CuCrO4 (C2=0,1 моль/л) | |
| Cd; CdCl2 (C1=0,1 моль/л) | Pb; PbCl2 (C2=0,1 моль/л) | |
| Cu; CuCl2 (C1=0,1 моль/л) | Pt, Cl2; 2Cl– (C2=1 моль/л) | |
| Cr; CrSO4 (C1=0,001 моль/л) | Ni; NiSO4 (C2=0,01 моль/л) | |
| Pt, H2; H2SO4 (C1=0,1 моль/л) | Ag; AgI (C2=0,01 моль/л) | |
| Zn; ZnCl2 (C1=1 моль/л) | Cr; CrCl3 (C2=0,1 моль/л) | |
| Pt, H2; H2SO4 (C1=0,1 моль/л) | Pb; PbSO4 (C2=1 моль/л) | |
| Fe; FeBr2 (C1=0,1 моль/л) | Cu; CuBr2 (C2=0,1 моль/л) | |
| Zn; ZnSO4 (C1=0,1 моль/л) | Cu; CuSO4 (C2=0,001 моль/л) | |
| Pt, H2; HCl (C1=1 моль/л) | Fe; FeCl2 (C2=0,1 моль/л) | |
| Sn; SnSO4 (C1=1 моль/л) | Pt, H2; H2SO4 (C2=1 моль/л) | |
| Fe; FeCl2 (C1=0,1 моль/л) | Ag; AgCl (C2=0,01 моль/л) | |
| Cd; CdI2 (C1=1 моль/л) | Ag; AgI (C2=1 моль/л) | |
| Cd; Cd(NO3)2 (C1=0,1 моль/л) | Cu; Cu(NO3)2 (C2=0,1 моль/л) | |
| Pt, Sn2+; Sn4+ (C1=1 моль/л) | Fe3+; Fe2+ (C2=1 моль/л) |
В задачах 421–445 составить схемы гальванических элементов, в которых протекают приведенные ниже токообразующие реакции. Вычислить э.д.с. элементов. Чему равно DG?
| № задачи | Токообразующая реакция |
| H2 + Cu2+ (C=0,1 моль/л) ® 2H+ (C=1моль/л) + Cu | |
| 2Al + 3Fe2+ (C=1моль/л) ® 2Al3+(C=0,01моль/л) + 3Fe | |
| Cd + CuSO4 (C=1моль/л) ® CdSO4 (C=1моль/л) + Cu | |
| Zn + 2H+ (C=1моль/л) ® Zn2+ (C=0,1 моль/л) + H2 | |
| Mg + H2SO4 (C=1моль/л) ® MgSO4 (C=1моль/л) + H2 | |
| Cu + 2AgNO3 (C=0,1 моль/л) ® Cu(NO3)2 (C=0,1 моль/л) + 2 Ag | |
| Mg + Fe2+ (C=1моль/л) ® Mg2+(C=0,01моль/л) + Fe | |
| Fe + Cu2+(C=0,01моль/л) ® Fe2+ (C=1моль/л) + Cu | |
| Ni + CuSO4 (C=1моль/л) ® NiSO4 (C=1моль/л) + Cu | |
| Cd + SnCl2 (C=0,1 моль/л) ® CdCl2 (C=0,01моль/л) + Sn | |
| Zn + Cu2+ (C=1моль/л) ® Zn2+ (C=1моль/л) + Cu | |
| Cu + Cl2 (C=1моль/л) ® Cu2+ (C=1моль/л) + 2Cl- | |
| Hg2+ (C=0,1 моль/л) + 2Ag ® Hg + 2Ag+(C=1×10-4моль/л) | |
| 3Zn + 2 Cr3+(C=1×10-3моль/л) ® 3Zn2+(C=1×10-4моль/л) + 2Cr | |
| Sr + H2SO4 (C=1моль/л) ® SrSO4 (C=1моль/л) + H2 | |
| Be + Cо2+ (C=0,1 моль/л) ® Be2+ (C=0,01моль/л) + Cо | |
| 2Fe(NO3)2 + Hg2(NO3)2 (C=1моль/л)® 2Fe(NO3)3(C=1моль/л)+2Hg | |
| Cu + 2AgCl(C=0,01моль/л) ® CuCl2 (C=0,001моль/л) + 2Ag | |
| H2 + 2Ag+ (C=1моль/л) ® 2H+ (C=0,1 моль/л) + 2Ag | |
| Cd + PbCl2 (C=0,01моль/л) ® CdCl2(C=0,01моль/л) + Pb | |
| Pb + 2AgNO3 (C=0,1 моль/л) ® Pb(NO3)2 (C=0,01моль/л) + 2Ag | |
| Zn +Hg2Cl2 (C=1моль/л) ® ZnCl2 (C=1моль/л) + 2Hg | |
| Cd + 2AgCl (C=0,1 моль/л) ® CdCl2 (C=0,01моль/л) + 2Ag | |
| Sc + Bi3+ (C=0,1 моль/л) ® Sc3+ (C=0,1 моль/л) + Bi | |
| Sn + CuCl2 (C=1моль/л) ® SnCl2 (C=1моль/л) + Cu |
В задачах 446–471 вычислить константы равновесия окислительно-восстановительных реакций, протекающих в гальванических элементах
| № задачи | Уравнение реакции |
| SnCl2 + 2FeCl3 ® SnCl4 + 2FeCl2 | |
| Zn + CdSO4 ® ZnSO4 + Cu | |
| Pb + Cu(NO3)2 ® Pb(NO3)2 + Cu | |
| Cu +2AgNO3 ® Cu(NO3)2 + 2Ag | |
| Mg + H2SO4 ® MgSO4 + H2 | |
| Zn + CuSO4 ® ZnSO4 + Cu | |
| Al + CrCl3® AlCl3 + Cr | |
| 5FeCl2 + KMnO4 + 8HCl ® MnCl2 + KCl + 5FeCl3 + 4H2O | |
| H3PO3 + 2AgNO3 + H2O ® H3PO4 + 2Ag + 2HNO3 | |
| 2KBr + PbO2 + 4HNO3 ® Pb(NO3)2 + Br2 + 2KNO3 + 2H2O | |
| Fe + CuSO4 ® FeSO4 + Cu | |
| Pb + Hg2Cl2 ® PbCl2 + 2Hg | |
| Cd + CuSO4 ® CdSO4 + Cu | |
| 4FeCl2 + O2 + 4HCl ® 4FeCl3 + 2H2O | |
| Mn + NiCl2 ® MnCl2 + Ni | |
| 2Al + 3 Pb(NO3)2 ® 2Al(NO3)3 + 3Pb | |
| Sn + HgSO4 ® SnSO4 + Hg | |
| FeBr2 + CoBr3 ® FeBr3 + Co | |
| Zn + Pb(NO3)2 ® Zn(NO3)2 + Pb | |
| 2FeSO4 +Cl2 + Na2SO4 ® 2NaCl + Fe2(SO4)3 | |
| Zn + Hg2Cl2 ® ZnCl2 + 2Hg | |
| Cu + 2AgCl ® CuCl2 + 2Ag | |
| Cd + SnCl2 ® CdCl2 + Sn | |
| Fe + Pb(NO3)2 ® Fe(NO3)2 + Pb | |
| Ni + CuSO4 ® NiSO4 + Cu | |
| Ca + H2SO4 ® CaSO4 + H2 |
Date: 2015-09-24; view: 693; Нарушение авторских прав