
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электролиз. Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока
|
|
Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока. Химические реакции при электролизе обратны реакциям в гальванических элементах.
При электролизе растворов солей необходимо помнить правила:
1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды:
2H2O +2e ® H2 + 2OH–.
2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода (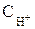 = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.
3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде.
4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (S2-, I-,Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды:
2H2O + 4e ® O2 + 4H+.
5. Растворимый анод сам подвергается окислению (растворению), т.е. поcылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором:
Me ↔ Men+ + ne.
металл уходят уходят во
анода в раствор внешнюю цепь
Date: 2015-09-24; view: 521; Нарушение авторских прав