
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры составления условий задач и их решения
|
|
Задача 335
Определить восстановитель и окислитель, расставить коэффициенты, пользуясь методом электронно-ионных полуреакций в следующих окислительно-восстановительных реакциях:
1. Na2SO3 + КМnО4 + H2O ® Na2SO4 + МnО2 + КОH
2. NaCrO2 + H2O2 + KOH ® Na2CrO4 + K2CrO4 + H2O
3. Mn(NO3)2 + РbO2 + HN03 ® HMnO4 + РЬ(N03)2 + H2O.
Решение:
1. В молекулярной схеме реакции определяем изменение степени окисления, находим окислитель и восстановитель:
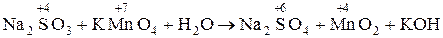
в-ль о-ль среда
 Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль
2 МnО4– + 2H2O + 3е ® МnO2 + 4OH- в-е, о-ль
Умножаем на полученные множители обе полуреакции и суммируем:
3 SO32– + 2 МnО4– + 7 H2O ® 3 SO42– + 2 МnO2 + 8 OH– + 6 Н+.
После преобразования ионное уравнение реакции будет иметь следующий вид:
3 SO32– + 2 МnО4– + H2O → 3 SO42– + 2 МnO2 + 2 OH–.
В молекулярной форме это уравнение запишется следующим образом:
3 Na2SO4 + 2 КМnО4 + H2O = 3 Na2SO4 + 2 МnО2 + 2 КОH.
2. 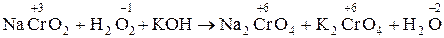 .
.
 2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
3 H2O2 + 2e ® 2 OH– в-е, о-ль
Для перехода CrO2– в ион CrO42– необходим кислород, который в щелочной среде выделяется из гидроксид-ионов (2ОН– → О2– + Н2О). Восстановление H2O2 в щелочной среде идет с образованием ионов OH–.
Умножаем на полученные множители обе полуреакции и суммируем:
2CrO2– + 3H2O2 + 8OH– ® 2CrO42– + 4H2O + 6OH–.
После преобразования ионное уравнение реакции следующее:
2 CrO2– + 3 H2O2 + 2 OH– → 2 CrO42– + 4 H2O.
На основе ионного уравнения запишем уравнение реакции в молекулярной форме:
2 NaCrO2 + 3 H2O2 + 2 KOH ® Na2CrO4 + K2CrO4 + 4 H2O.
3. 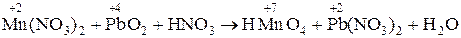 .
.
 |
2 Mn+2 + 4 H2O – 5е ® MnO4– + 8 Н+ o-e, в-ль
5 РbO2 + 4 Н+ + 3е ® Рb2+ + 2 H2O в-е, о-ль
После преобразования ионное уравнение реакции будет иметь вид:
2 Mn+2 + 5 РbO2 + 4 Н+ = 2 MnO4– + 5 Рb2+ + 2 H2O.
2 Mn(NO3)2 + 5 РbO2 + 6 HNO3 = 2 HMnO4 + 5 Рb(NO3)2 + 2H2O.
В рассмотренных реакциях взаимодействуют вещества, одно из которых служит окислителем, а другое - восстановителем, третье - средой. Такие реакции относятся к реакциям межмолекулярного окисления-восстановления. Реакция 330(1) служит примером реакций самоокисления - самовосстановления (диспропорционирования), в которых функции окислителя и восстановителя выполняет один и тот же элемент. В реакции 330(2) оба элемента (восстановитель и окислитель) входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления.
В задачах 330–391 определить восстановитель и окислитель, расставить коэффициенты, пользуясь методам электронно-ионных или электронных полуреакций
| № задачи | Уравнение окислительно-востановительной реакции |
| S + KOH ® K2SO3 + K2S + H2O (NH4)2Cr2O7 ® N2 + Cr2O3 + H2O Cu + HNO3 ® Cu(NO3)2 + NO + H2O | |
| H3PO3 + AgNO3 + H2O ® H3PO4 + Ag + HNO3 NaBrO3 + NaBr + H2SO4 ® Br2 + Na2SO4 + H2O MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O | |
| NaHSO3 + Cl2 + H2O ® NaHSO4 + HCl H2Se + K2Cr2O7 + H2SO4 ® Se + Cr2(SO4)3 + K2SO4 + H2O Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr +H2O | |
| P + HNO3 + H2O ® H3PO4 +NO H2O2 + KMnO4 + KOH ® O2 + K2MnO4 + H2O NaBr + NaBrO3 + HNO3 ® Br2 + NaNO3 + H2O | |
| HNO2 + Br2 + H2O ® HNO3 + HBr As2S3 + H2O2 + NH4OH ® (NH4)3AsO4 + (NH4)2SO4 + H2O MnSO4 + NaBiO3 + HNO3 ®HMnO4 + Na2SO4 +Bi(NO3)3+NaNO3+ Н2О | |
| Se + HNO3 + H2O ® H2SeO3 + NO Cr2(SO4)3 + Br2 + KOH ® K2CrO4 + KBr + K2SO4 + H2O Hg + NaNO3 + H2SO4 ® Na2SO4 + Hg2SO4 + NO +H2O | |
| As2Se5 + HNO3 + H2O ® H3AsO4 + H2SeO4 +NO AsH3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O Cr2(SO4)3 + H2O2 + KOH ® K2CrO4 + K2SO4 + H2O | |
| Na2SO3 + KMnO4 + H2O ® MnO2 + Na2SO4 + KOH NaCrO2 + H2O2 + NaOH ® Na2CrO4 + H2O Mn(NO3)2 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + H2O | |
| Na2SO3 + K2Cr2O7 + H2SO4 ® Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O NaAsO2 + I2 + Na2CO3 + H2O ® NaH2AsO4 + NaI + CO2 Br2 + NaOH ® NaBrO3 + NaBr + H2O | |
| Ca(ClO)2 + NaBr + H2O ® CaCl2 + Br2 + NaOH Na2SeO3 + F2 + NaOH ® Na2SeO4 +NaF + H2O PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 +H2O | |
| Na3AsO3 + I2 + H2O ® Na3AsO4 + HI MnO2 + KNO3 + KOH ® K2MnO4 + KNO2 + H2O K2S + NaOCl + H2SO4 ® S + K2SO4 + NaCl + H2O | |
| Fe(CrO2)2 + Cl2 + K2CO3 ® FeCl3 + K2CrO4 + KCl + CO2 KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O MnCl + KBrO + KOH ® MnO2 + KBr + KCl + H2O | |
| CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O FeS2 + HNO3 ® Fe(NO3)3 + NO + H2SO4 + H2O K4[Fe(CN)6] + Br2 ® K3[Fe(CN)6] + KBr | |
| NaCrO2 + H2O2 + NaOH ® Na2CrO4 + H2O Co(OH)2 + O2 + H2O ® Co(OH)3 Zn + HNO3 ® Zn(NO3)2 + NH4NO3 + H2O | |
| PH3 + KClO3 + KOH ® KCl + K3PO4 + H2O KNO3 + Na2Cr2O7 + HCl ® KNO3 + CrCl3 + NaCl + H2O Al + NaOH + H2O ® Na[Al(OH)4] + H2 | |
| Ni(OH)2 + Br2 + H2O ® Ni(OH)3 + HBr CrBr3 + H2O2 + KOH ® K2CrO4 + KBr + H2O Au + HCl + HNO3 ® H[AuCl4] + NO + H2O | |
| H2O2 + AgNO3 + NH4OH ® O2 + Ag + NH4NO3 + H2O Na3AsO3 +K2Cr2O7 + H2SO4®Na3AsO4 + Cr2(SO4)3 + K2SO4 +H2O Sb2S5 + HNO3 + H2O ® H3SbO4 + H2SO4 + NO | |
| NaOCl + KI + H2SO4 ® NaCl + I2 + K2SO4 + H2O Na2SnO2 + Bi(OH)3 ® Na2SnO3 + Bi + H2O AsH3 + AgNO3 + H2O ® H3AsO4 + Ag + HNO3 | |
| Sb2S3 + H2O2 + NaOH ® Na3SbO4 + Na2SO4 + H2O Fe2(SO4)3 + KI ® I2 + FeSO4 + K2SO4 SO2 + K2Cr2O7 + H2SO4 ® K2SO4 + Cr2(SO4)3 + H2O | |
| Na3CrO3 + PbO2 + NaOH ® Na 2CrO4 + Na2PbO2 + H2O Na2S2O3 + Cl2 + H2O ® H2SO4 + Na2SO4 + HCl Al + K2Cr2O7 + H2SO4 ® Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O | |
| Fe(OH)2 + O2 + H2O ® Fe(OH)3 Sb2O3 + Cl2 + KOH ® KSbO3 + KCl + H2O K4[Fe(CN)6] + Br2 ® K3[Fe(CN)6] + KBr | |
| Fe2O3 + KClO3 + KOH ® K2FeO4 + KCl + H2O HIO3 + H2O2 ® I2 + O2 + H2O FeS2 + O2 ® Fe2O3 + SO2 | |
| Mn(NO3)2+[Ag(NH3)2]OH +H2O®H2MnO3+Ag + NH4NO3+ NH4OH Na2SO3 + KMnO4 + H2SO4 ® MnSO4 + Na2SO4 + K2SO4 + H2O I2 + NaOH ® NaIO + NaI + H2O | |
| Fe(OH)3 + KClO4 + KOH ® K2FeO4 + KCl + H2O NaBiO3 + MnCl2 + HCl ® NaMnO4 + BiCl3 + NaCl + H2O K2MnO4 + H2O ® KMnO4 + MnO2 + KOH | |
| Te + HClO3 + H2O ® H6TeO6 + Cl2 H2O2 + AgNO3 + NH4OH ® O2 + Ag + NH4NO3 + H2O H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 +H2O | |
| FeCl2 + HNO3 + HCl ® FeCl3 + NO + H2O AsH3 + AgNO3 + H2O ® Ag + H3AsO4 + HNO3 CrBr3 + H2O2 + NaOH ® Na2CrO4 + NaBr + H2O | |
| KI + (NH4)2Cr2O7 + H2SO4 ® I2 + Cr2(SO4)3 + K2SO4+(NH4)2SO4+ H2O Cl2 + I2 + H2O ® HIO3 + HCl Zn + NaClO3 + NaOH ® Na2[Zn(OH)4] + NaCl + H2O | |
| As2S5 + HNO3 ® H3AsO4 + H2SO4 + NO2 Ag2SeO3 + Br2 + H2O ® H2SeO4 + AgBr H2O2 + AuCl3 + NaOH ® O2 + Au + NaCl + H2O | |
| Al + KNO3 + KOH +H2O ® KAlO2 + NH3 Na2S2O3 + HOCl + H2O ® H2SO4 + NaCl + HCl S + HNO3 ® H2SO4 + NO2 + H2O | |
| KNO2 + KMnO4 + H2SO4 ® KNO3 + MnSO4 + K2SO4 +H2O K3[Cr(OH)6] + Cl2 + KOH ® K2CrO4 + KCl + H2O Br2 + SO2 + H2O ® HBr + H2SO4 | |
| Pt + HNO3 + HCl ® H2[PtCl6] + NO + H2O Br2 + KOH(хол) ® KBrO + KBr + H2O MnSO4 + KMnO4 + H2O ® MnO2 + K2SO4 + H2SO4 | |
| Al + HNO3(разб) ® Al(NO3)3 + N2 + H2O W + NaNO3 + NaOH ® Na2WO4 + NaNO2 + H2O KBrO3 + XeF2 + H2O ® KbrO4 + Xe + HF | |
| Au + H2SeO4 ® Au2(SeO4)3 + SeO2 + H2O Cl2 + KOH (гор) ® KCl + KClO3 + H2O SO2 + NO2 + H2O ® H2SO4 + NO | |
| C6H12O6 + KMnO4 + H2SO4 ® CO2 + MnSO4 + K2SO4 + H2O Fe2O3 + KNO3 + KOH ® K2FeO4 + KNO2 + H2O As + Cl2 + H2O ® H3AsO4 + HCl | |
| H2S + KMnO4 + H2SO4 ® S + MnSO4 + K2SO4 + H2O K3[Cr(OH)6] + Br2 + KOH ® K2CrO4 + KBr + H2O Be + NaOH + H2O ® Na[Be(OH)4] + H2 | |
| KBr + K2Cr2O7 + H2SO4 ® Br2 + Cr2(SO4)3 + K2SO4 + H2O Ge + H2O2 + NaOH ® Na2GeO3 + H2O CO + PdCl2 + H2O ® Pd + HCl + CO2 | |
| Si + HNO3 + HF ® H2[SiF6] + NO +H2O Br2 + KOH (гор) ® KBr + KBrO3 + H2O Co(OH)2 + NaClO + H2O ® Co(OH)3 + NaCl | |
| FeCl2+KMnO4+H2SO4®MnSO4 +FeCl3 + Fe2(SO4)3 + KCl +H2O CuO + NH3 ® Cu + N2 + H2O Ti + HNO3 + H2O ® H2TiO3 + NO | |
| Nb + HNO3 + HF ® H2[NbF7] + NO + H2O SiC + NaOH + O2 ® Na2SiO3 + H2O + CO2 Ni(OH)2 + Cl2 + KOH ® Ni(OH)3 + KCl | |
| FeSO4 + HNO3 + H2SO4 ® Fe2(SO4)3 + NO2 + H2O Cl2 + NaOH (гор) ® NaCl + NaClO3 + H2O K2SO3 + KMnO4 + H2O ® MnO2 + K2SO4 + KOH | |
| K2Cr2O7 + HCl (конц.) ® CrCl3 + Cl2 + KCl + H2O Na3[Cr(OH)6] + Br2 + NaOH ® Na2CrO4 + NaBr + H2O Zn + NaOH + H2O ® Na2[Zn(OH)4] + H2 | |
| Re + HNO3 ® HReO4 + NO + H2O Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O CuSO4 + Na2CO3 + H2O ® (CuOH)2CO3 + 2Na2SO4 + CO2 | |
| H2C2O4 + KMnO4 + H2SO4 ® CO2 + MnSO4 + K2SO4 + H2O K3ASO3 + I2 + KOH ® K3AsO4 + KI + H2O Si + KOH + H2O ® K2SiO3 + H2 | |
| CH3OH + KMnO4 + H2SO4® HCOOH +MnSO4 + K2SO4 +H2O Zn + KNO3 + KOH ® K2ZnO2 + KNO2 + H2O SeO2 + SO2 + H2O ® H2SO4 + Se | |
| Os + HNO3 ® [Os(H2O)2O4] + NO2 +H2O NaBrO3 + F2 + NaOH ® NaF + NaBrO4 + H2O K2S + KMnO4 + H2O ® S + MnO2 + KOH | |
| HCl + H2SeO4 (конц.) ® H2SeO3 + Cl2 + H2O Zn + AgO + KOH ® K2ZnO2 + Ag + H2O Pb + KOH + H2O ® K4[Pb(OH)6] + H2 | |
| C + H2SO4 ® CO2 + SO2 + H2O ClO2 + KOH ® KClO3 + KClO2 + H2O As2S3 +HNO3 + H2O ® H3AsO4 + H2SO4 + NO | |
| Zn + KMnO4 + H2SO4 ® ZnSO4 + MnSO4 + K2SO4 + H2O K2SO3 + KMnO4 + KOH ® K2SO4 + K2MnO4 + H2O Br2 + Cl2 + H2O ® HCl + HBrO3 | |
| KI + K3AsO4 + H2SO4 ® I2 + K3AsO3 + K2SO4 + H2O Cr(OH)3 + Cl2 + NaOH ® Na2CrO4 + NaCl + H2O H2S + Cl2 + H2O ® HCl + H2SO4 | |
| FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O Cr2O3 + Br2 + KOH ® KBr + K2CrO4 + H2O MoO3 + Na2CO3 + H2O ® Na2MoO4 + NaHCO3 | |
| W + HNO3 + HF ® H2[WF8] + NO + H2O Al + NaNO3 + NaOH + H2O ® NaAlO2 + NH3 P + HClO3 + H2O → H3PO4 + HCl | |
| Mo + HNO3 + HF ® H2[MoF8] + NO + H20 Cl2 + NaOH(хол) ® NaClO + NaCl + H2O Cr2O3 + NaBrO3 + H2O ® Na2Cr2O7 + HCr2O7 + Br2 | |
| FeO + HNO3 ® Fe(NO3)3 + NO + H2O Zn + NaNO3 + NaOH + H2O ® Na2[Zn(OH)4] + NH3 KOCl + CO2 + H2O ® KHCO3 + HOCl | |
| MnS + HNO3 ® MnSO4 + NO2 + H2O V + O2 + KOH ® K3[VO4] + H2O Si + NaOH + H2O ® Na2SiO3 +H2 | |
| Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 +H2O Ca3(PO4)2 + C +SiO2 ® CaSiO3 + P + CO SO2 + Br2 + H2O ® H2SO4 + HBr | |
| H3PO3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 +H2O KCrO2 + H2O2 + KOH ® K2CrO4 + H2O SO2 + CaOCl2 + H2O ® CaSO4 + HCl | |
| HCl + KMnO4 ® Cl2 + KCl +MnCl2 + H2O Mo + NaNO3 + NaOH ® Na2MoO4 + NaNO2 + H2O Au + KCN + H2O + O2 ® K[Au(CN)2] + KOH | |
| NaJ + NaNO2 + H2SO4 ® NO + J2 + Na2SO4 +H2O Cr2(SO4)3 + Cl2 + NaOH ® Na2CrO4 + NaCl + Na2SO4 + H2O Na2SO3 + Br2 + H2O ® Na2SO4 + HBr | |
| V + H2SO4 ® (VO)SO4 + SO2 + H2O KNO2 + KMnO4 + KOH ® KNO3 + K2MnO4 + H2O XeF2 + H2O ® Xe + O2 +HF | |
| V + HNO3 + HCl ® VCl4 + NO + H2O CrCl3 + NaClO + NaOH ® Na2CrO4 + NaCl + H2O SO2 + NaJO3 + H2O ® NaJ + H2SO4 | |
| PbS + HNO3(конц) ® PbSO4 + NO2 + H2O Fe(OH)3 + Br2 + KOH ® K2FeO4 +KBr +H2O As2S5 + HNO3 + H2O ® H3AsO4 + H2SO4 + NO | |
| K2MnO4 + H2S ® MnO2 + S+ KOH CrCl3 + KClO3 + KOH ® K2CrO4 + KCl + H2O KBr +KMnO4 + H2O ® Br2 + MnO2 + KOH |
Date: 2015-09-24; view: 792; Нарушение авторских прав