
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электролиз. Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему
|
|
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита.
На электродах происходит разряд ионов и превращение их в нейтральные атомы или молекулы. На отрицательном электроде (катоде) происходит процесс восстановления, а на положительном (аноде) - процесс окисления.
На катоде при электролизе всегда происходит разряд положительных ионов, находящихся в растворе. Если металл находится в ряду напряжений выше алюминия (включая его), то происходит восстановление воды; а если ниже Al, то происходит осаждение металла.
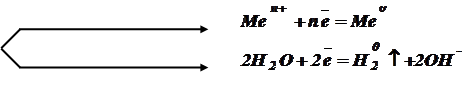 Ме ниже Al
Ме ниже Al
К (-)
Ме выше Al и Al
Процессы, протекающие на аноде, зависят от того, является анод растворимым или нерастворимым. К числу нерастворимых анодов относятся платина, золото, графит, уголь. На них происходит окисление отрицательных ионов, находящихся в растворе. На аноде разряжаются ионы безкислородных кислотных остатков, а разряд анионов кислородсодержащих кислот в обычных условиях электролиза не наблюдается, а вместо этого происходит окисление воды.




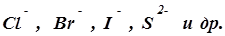
А (+)

Если анод сделан из металла менее благородного, чем золото и платина, т.е. такого, который может посылать свои ионы в раствор - разряд отрицательных ионов на аноде не происходит. Рассмотрим процесс электролиза CuCl2 с двумя медными электродами. На катоде происходит выделение металлической меди:
Cu+2 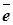 =Cu0
=Cu0
А на аноде происходит растворение металлической меди:
Cu0-2 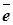 =Cu2+
=Cu2+
Количество CuCl2, находящееся в растворе, остается неизменным, так как процесс электролиза сводится к растворению меди на аноде и выделению ее на катоде. Этот вид электролиза используется для гальванического покрытия металлов и для электролитической очистки металлов (рафинирование).
В 30-х годах XIX века английский физик М. Фарадей установил, что масса вещества, выделившаяся при электролизе, прямо пропорциональна эквивалентной массе выделившегося вещества и количеству прошедшего электричества:
m=  (9.1)
(9.1)
где m - масса выделившегося вещества, г; mэ - эквивалентная масса выделившегося вещества, 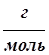 ; I - сила тока, А; t - время электролиза, с; F - постоянная Фарадея, равная 96500 Кл.
; I - сила тока, А; t - время электролиза, с; F - постоянная Фарадея, равная 96500 Кл.
Объем выделившегося газообразного вещества определяется по формуле:
V=  (9.2)
(9.2)
где Vэ - эквивалентный объем выделившегося вещества, 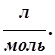
Date: 2015-09-22; view: 498; Нарушение авторских прав