
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гидролиз солей. Гидролиз - это обменное взаимодействие соли с водой, в результате которого образуется слабая кислота или слабое основание
|
|
Гидролиз - это обменное взаимодействие соли с водой, в результате которого образуется слабая кислота или слабое основание.
Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза в растворе образуются гидроксильные ионы и он приобретает щелочную реакцию, например:
NaCN+H2OÛHCN+KOH
CN-+H2OÛHCN+OH-
При гидролизе соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли; при этом в растворе возрастает концентрация ионов водорода, и он приобретает кислую реакцию, например:
AlCl3+H2OÛAlOHCl2+HCl
Al3++H2OÛAlOH2++H+
При взаимодействии с водой соли, образованной слабой кислотой и слабым основанием, гидролизу подвергаются как катион, так и анион соли; например, при гидролизе карбоната аммония:
(NH4)2CO3+H2OÛNH4HCO3+NH4OH
параллельно протекают два процесса:
NH4++H2OÛNH4OH+H+
CO32-+H2OÛHCO3-+OH-
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Если Ккисл @ Косн, то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной; если Ккисл > Косн, то катион соли гидролизуется в большей степени, чем анион, и реакция раствора будет слабокислой, а если Ккисл < Косн, то реакция раствора будет слабощелочной.
Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, так как в этом случае обратная гидролизу реакция нейтрализации практически протекает до конца.
Гидролиз соли, образованной слабой кислотой АВ и сильным основанием, характеризуется константой гидролиза Кг:
Кг= 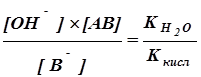 (7.1)
(7.1)
где К 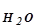 - ионное произведение воды.
- ионное произведение воды.
Аналогично для соли слабого основания МОН и сильной кислоты:
Кг= 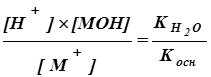 (7.2)
(7.2)
Степенью гидролиза h называется доля электролита, подвергшаяся гидролизу. Она связана с константой гидролиза Кг уравнением:
Кг= 
 (7.3)
(7.3)
Чаще всего гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h <<1, и в знаменателе последней формулы этой величиной можно пренебречь.
Кг=h2´Cм (7.4)
h=  (7.5)
(7.5)
Гидролиз солей, образованных слабыми многоосновными кислотами, протекает ступенчато, причем продуктами первых стадий гидролиза являются кислые соли.
1 ступень Na2CO3+H2OÛNaHCO3+NaOH
CO32-+H2OÛHCO3-+OH-
2 ступень NaHCO3+H2OÛH2CO3+NaOH
HCO3-+H2OÛH2CO3+OH-
Также ступенчато протекает гидролиз солей, образованных слабыми основаниями многовалентных металлов. В результате гидролиза по первым ступеням образуется основная соль.
1 ступень AlCl3+H2OÛAlOHCl2+HCl
Al3++H2OÛAlOH2++H+
2 ступень AlOHCl2+H2OÛAl(OH)2Cl+HCl
AlOH2++H2OÛAl(OH)2++H+
3 ступень Al(OH)2Cl+H2OÛAl(OH)3+HCl
Al(OH)2++H2OÛAl(OH)3+H+
Date: 2015-09-22; view: 491; Нарушение авторских прав