
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ионное произведение воды. Водородный показатель
|
|
Вода является очень слабым электролитом, поэтому она незначительно диссоциирует, образуя ионы водорода и гидроксильные ионы:
H2O(ж.)ÛН+(водн.)+ОН-(водн.)
Этому процессу соответствует константа диссоциации:
K= 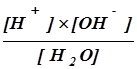
Концентрация воды в водных растворах обычно очень велика, приблизительно 55М, и в разбавленных растворах остается практически постоянной. Поэтому принято исключать концентрацию воды из выражения для константы ее диссоциации в водных растворах. Это позволяет написать выражение для константы диссоциации воды в таком виде:
К´[Н2О]=КН 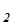 O=[H+]´[OH-] (5.1)
O=[H+]´[OH-] (5.1)
Произведение двух постоянных величин, К и [H2O], дает новую постоянную, КН 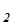 O. Эта константа равновесия называется ионным произведением воды. При 25оС ионное произведение воды КH
O. Эта константа равновесия называется ионным произведением воды. При 25оС ионное произведение воды КH 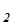 O имеет величину 1.0´10-14.
O имеет величину 1.0´10-14.
КН 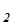 O=[H+]´[OH-]=1.0´10-14 (5.2)
O=[H+]´[OH-]=1.0´10-14 (5.2)
Выражение (5.2) применимо не только к чистой воде, но и к водным растворам. Раствор, в котором [H+]=[OH-], называют нейтральным. Но в большинстве растворов концентрации ионов Н+ и ОН- не совпадают. Если концентрация одного из этих ионов возрастает, концентрация другого должна уменьшаться так, чтобы их произведение по-прежнему оставалось постоянным: в любом случае ионное произведение воды должно быть равно 1.0´10-14. В кислых растворах величина [H+] больше [OH-], а в основных растворах, наоборот, [OH-] больше [Н+].
Кислотно-основные свойства воды имеют большое значение во многих отраслях науки. Так, например, от кислотности или основности воды очень сильно зависят разложение химических загрязнителей в сточных водах, скорость коррозии металлических предметов, находящихся в воде, а также пригодность водной среды к обитанию в ней рыб и растений. Концентрацию ионов Н+ и ОН - в таких растворах часто выражают при помощи водородного рН и гидроксильного рОН показателей.
рН=-lg[H+] (5.3)
pOH=-lg[OH-] (5.4)
Логарифмируя соотношение (5.2) и меняя знак на обратный, при 25оС получим:
рН+рОН=14 (5.5)
При этой температуре в нейтральных растворах рН =7, в кислых - рН <7, в щелочных - рН >7.
Date: 2015-09-22; view: 523; Нарушение авторских прав