
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Растворы электролитов и неэлектролитов
|
|
Электролитами называют вещества, водные растворы которых обладают способностью проводить электрический ток.
В качестве примера рассмотрим хлорид натрия; при его растворении в воде образуются ионы Na+ и Сl-, которые могут свободно перемещаться в растворе. В литре одномолярного раствора NaCl (1.0M NaCl) в действительности содержится 1.0 моль ионов Na+ и 1.0 моль ионов Сl-. В растворе NaCl полностью ионизируется. Соединения, способные полностью ионизироваться при растворении, называются сильными электролитами. Растворенные в воде глюкоза (С6Н12О6) или этанол (С2Н5ОН) не распадаются на ионы, а сохраняют в растворе свое молекулярное строение. Такие соединения называют неэлектролитами. Некоторые вещества, содержащие сильнополярные связи, но все же не относящиеся к числу ионных веществ, при растворении в воде подвергаются неполной ионизации. Например, при растворении в воде HgCl2 устанавливается равновесие вида:
HgCl2 (водн.)Û HgCl+( водн.)+ Сl- (водн.)
В виде ионов в растворе существует лишь небольшая часть HgCl2. Это соединение - пример слабого электролита.
Процесс распада электролита на положительно и отрицательно заряженные ионы (катионы и анионы) называется электролитической диссоциацией.
Степенью диссоциации a электролита называется доля его молекул, подвергшихся диссоциации, т.е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
В случае электролита АВ, диссоциирующего на ионы А+ и В-, константы и степень диссоциации связаны соотношением (закон разведения Оствальда):
К=  (4.1)
(4.1)
где См - молярная концентрация электролита, 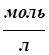 .
.
Если степень диссоциации значительно меньше единицы, то можно принять (1- a)@1. Тогда выражение (4.1) упрощается:
К=a2´См, (4.2)
откуда
a=  (4.3)
(4.3)
Если в растворе электролита АВ степень его диссоциации равна a, то концентрации ионов А+ и В- в растворе одинаковы и составляют:
[А+]=[B-]=a´Cм
[A+]=[B-]=Cм´  =
= 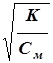 .
.
Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества (молекул и ионов) в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Поэтому коллигативные свойства раствора, такие как понижение давления паров, повышение температуры кипения, понижение температуры затвердевания и осмотическое давление, проявляются в растворах электролитов в большей степени, чем в равных по концентрации растворах неэлектролитов. Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете коллигативных свойств. В этом случае формулы (3.1.1), (3.2.1), (3.3.1), (3.4.1) приобретут следующий вид:
р(А)=i´Х(А)´ро(А), (4.4)
где i - изотонический коэффициент.
DТкип=i´Ккип´Сg (4.5)
DTзатв=i´Kзатв´Сg (4.6)
pосм=i´См´R´T (4.7)
Изотонический коэффициент i связан со степенью диссоциации электролита a соотношением:
i=1+a´(k-1), (4.8)
где k - число ионов, на которые распадается при диссоциации молекула электролита, (для NaCl k =2, для K2SO4 k =3).
Не следует путать растворимость вещества с его принадлежностью к сильным или слабым электролитам. Например, хлорид серебра (AgCl) имеет очень низкую растворимость в воде, поэтому даже после длительного встряхивания смеси AgCl с водой большая часть соли все же останется нерастворившейся. Однако вся растворившаяся соль находится в растворе в виде ионов Ag+ и Cl-, поэтому AgCl относят к числу сильных электролитов.
Кислоты и основания обычно различают по степени их ионизации в растворе. Кислоты и основания, не полностью ионизированные в растворе, называют соответственно слабыми кислотами и слабыми основаниями. Термины “слабая кислота” или “слабое основание” вовсе не характеризуют реакционную способность кислоты или основания. Плавиковая кислота (HF) - слабый электролит, поэтому ее называют слабой кислотой. В 0.1М растворе HF ионизировано всего 8 % молекул этого вещества. Однако HF - это кислота с очень высокой реакционной способностью, агрессивно взаимодействующая со многими веществами, включая стекло.
Решая вопрос о том, к сильным или слабым электролитам относится то или иное вещество, полезно руководствоваться следующими закономерностями:
1. Кислоты. К числу наиболее распространенных сильных кислот относятся HCl, HBr, HI, HNO3, H2SO4 и HClO4. Почти все остальные кислоты принадлежат к числу слабых электролитов.
2. Основания. К числу наиболее распространенных сильных оснований относятся гидроксиды щелочных и щелочноземельных металлов (кроме Ве). NH3 представляет собой слабый электролит.
3. Соли. Большинство распространенных солей, т.е. ионных соединений, - сильные электролиты. Исключения составляют соли главным образом тяжелых металлов, как, например, HgCl2.
Date: 2015-09-22; view: 1352; Нарушение авторских прав