
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Пример 2. В сосуде объемом 1 л находится 0,50 моля HI при 448°С
|
|
В сосуде объемом 1 л находится 0,50 моля HI при 448°С. Значение константы равновесия Кс для реакции Н2(г.)+I2(г.) 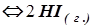 при указанной температуре равно 50,5. Каковы концентрации Н2, I2 и HI в сосуде при равновесных условиях?
при указанной температуре равно 50,5. Каковы концентрации Н2, I2 и HI в сосуде при равновесных условиях?
Решение. В данном случае не известна ни одна из равновесных концентраций; заданы лишь исходные концентрации [ H2 ] = [ I2 ] = 0 и [ HI ] = 0,50 M. Для того, чтобы выразить равновесные концентрации через начальные концентрации, необходимо воспользоваться полным уравнением реакции. Для этого построим таблицу концентраций. Обозначим количество HI, которое прореагирует с образованием Н2 и I2, через Х. При разложении Х молей HI образуется (Х/2) молей Н2 и (Х/2) молей I2. Таким образом:
Н2(г.)I2(г.)2HI(г.)
Исходные концентрации 0 М 0 М 0,50 М
Изменение концентраций (Х/2) М (Х/2)М Х М
Равновесные концентрации (Х/2) М (Х/2)М (0,50-Х) М
Теперь подставим равновесные концентрации в выражение для константы равновесия и вычислим с ее помощью единственную неизвестную величину Х:
Kc= 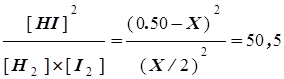
X =0,11M
Равновесные концентрации участников реакции таковы:
[ H2 ] = 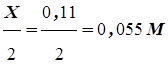
[ I2 ] = 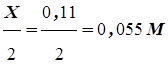
[ HI ] =0,50-0,11=0,39 M
7.2.4 Факторы, влияющие на равновесие. Принцип Ле Шателье.
Для предсказания влияния изменений внешних условий на поведение равновесной системы пользуются принципом Ле Шателье, который гласит: если равновесие в системе нарушается в результате изменения температуры, давления или концентрации одного из компонентов, положение равновесия смещается таким образом, чтобы противодействовать этому изменению.
В системе, находящейся в состоянии динамического равновесия, прямой и обратный процессы протекают с одинаковыми скоростями. Изменение условий, в которых находится система, может нарушить состояние равновесия. В результате этого равновесие смещается до тех пор, пока не установится новое равновесие. Принцип Ле Шателье указывает, что смещение равновесия должно происходить в таком направлении, чтобы свести к минимуму или уменьшить влияние воздействия, вызвавшего нарушение равновесия. Следовательно, если в химическую систему, находящуюся в равновесии, добавить какое-либо вещество (реагент или продукт), реакция смещается таким образом, чтобы равновесие восстанавливалось в результате поглощения части добавленного вещества. И наоборот, удаление из равновесной системы какого-либо вещества приводит к смещению равновесия в направлении, соответствующем образованию дополнительного количества данного вещества.
Если повышать полное давление системы, находящейся в состоянии равновесия, путем уменьшения ее объема, то система реагирует на это смещением равновесия в сторону уменьшения объема. Практически это означает, что смещение происходит в сторону уменьшения числа молей газа в системе. И наоборот, уменьшение давления в результате увеличения объема приводит к смещению реакции в сторону образования дополнительного количества молекул газа.
Изменение концентраций или полного давления могут вызывать смещение равновесия, но константа равновесия при этом не изменяется. Однако изменения температуры влияют на величину констант равновесия почти всех реакций. Константы равновесия всех экзотермических реакций, т.е. реакций, протекающих с выделением теплоты, при повышении температуры уменьшаются. В отличие от этого константы равновесия эндотермических реакций с повышением температуры увеличиваются. Следовательно, если реакция в прямом направлении является экзотермической, в обратном направлении она должна быть эндотермической; если теплота подводится к равновесной системе, которая является экзотермической в направлении прямой реакции, то равновесие смещается в обратном направлении, т.е. в сторону образования реагентов.
Пример
Рассмотрим реакцию:
N2O4(г.) 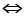 2NO2(г.)
2NO2(г.)  Н° =58,0 кДж
Н° =58,0 кДж
В каком направлении должно смещаться ее равновесие при: а) добавлении N2O4; б) удалении NO2; в) повышении давления; г) увеличении объема;
д) понижении температуры?
Решение. Для определения влияния всех этих изменений можно воспользоваться принципом Ле Шателье.
а) при добавлении N2O4 концентрация этого вещества в системе должна уменьшиться, следовательно, реакция сместится в сторону образования большего количества продуктов (в правую сторону уравнения);
б) при удалении NO2 в системе образуется дополнительное количество NO2 и равновесие сместится в сторону образования продуктов (вправо);
в) в системе установится новое равновесие, соответствующее меньшему объему (с меньшим числом молекул газа), следовательно, реакция должна сместиться влево;
г) равновесие в системе сместится в сторону возрастания объема системы (повышения числа молекул газа), т.е. вправо;
д) система ответит на повышение температуры смещением равновесия в сторону выделения теплоты. Реакция является эндотермической в прямом направлении (слева направо). Поэтому равновесие должно сместиться влево, так как при образовании дополнительного количества N2O4 произойдет выделение теплоты. Только это последнее изменение оказывает влияние на численное значение константы равновесия К.
Истинное химическое равновесие всегда включает конкуренцию двух противоположно направленных процессов, протекающих с одинаковой скоростью, независимо от конкретного механизма или пути реакции, по которому она осуществляется.
Date: 2015-09-22; view: 632; Нарушение авторских прав