
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гальванические элементы
|
|
Энергию, выделяющуюся в любой самопроизвольной окислительно-восстановительной реакции, можно непосредственно использовать для выполнения электрической работы. Это осуществлено в гальваническом элементе, представляющем собой устройство, в котором перенос электронов происходит по внешнему пути, а не непосредственно между реагентами.
Два металлических элемента, соединенных внешней цепью, называются электродами. Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов - двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn+Cu(NO3)2=Zn(NO3)2+Cu
изображается следующим образом
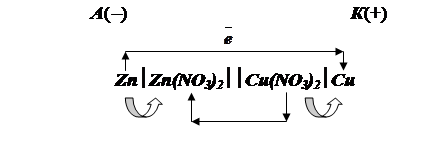 |
В данном случае металлические электроды непосредственно участвуют в реакции.
На аноде цинк окисляется
Zn0-2 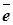 =Zn2+
=Zn2+
и в форме ионов переходит в раствор, а на катоде медь восстанавливается
Cu2++2 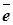 =Cu0
=Cu0
и в виде металла осаждается на электроде.
Складывая уравнения электродных процессов, получаем суммарное уравнение реакции:
Zn+Cu2+=Zn2++Cu
Гальванический элемент можно рассматривать как источник “движущей силы”, перемещающей электроны по внешней цепи от анода к катоду. Эта движущая сила называется электродвижущей силой (э.д.с.) и измеряется в вольтах (В). Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой Е0 данного элемента.
Э.д.с. гальванического элемента может быть представлена как разность двух электродных потенциалов j, каждый из которых отвечает полуреакции, протекающей на одном из электродов.
Е=jк-jА (8.1)
На практике гальванические элементы редко действуют при стандартных условиях. Однако э.д.с. элемента, работающего при нестандартных условиях, можно вычислить по Е0, температуре и концентрациям реагентов и продуктов в гальваническом элементе. Уравнение, позволяющее проводить такие расчеты, получило название уравнения Нернста:
jМе/Меn+=j0+ 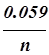 ´lg[Men+] (8.2)
´lg[Men+] (8.2)
где j0 - стандартный электродный потенциал, В; n - степень окисления элемента; [Men+] - концентрация металла, участвующего в соответствующей полуреакции.
Концентрацию металла рассчитываем по следующей формуле:
[Men+]=k´Cм´a (8.3)
где k - количество ионов металла в одной молекуле соли; См - молярная концентрация металла в растворе соли, 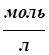 ; a - степень диссоциации электролита, д.ед.
; a - степень диссоциации электролита, д.ед.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов.
Date: 2015-09-22; view: 478; Нарушение авторских прав