
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Диаграмма электронной плотности в кристалле NaCl: Числами обозначена электронная плотность в относительных единицах
|
|
Ионный радиус равен расстоянию от ядра до точки с минимальной электронной плотностью, лежащей на оси, которая соединяет ядра катиона и аниона.
Ионные радиусы уменьшаются с ростом заряда иона (табл. 11.6) и увеличиваются с возрастанием координационного числа.
Так как в ионной решетке каждый ион взаимодействует со всеми другими, понятие энергии связи в ионном кристалле не имеет смысла и вместо него применяется иная характеристика — энергия кристаллической ионной решетки.
Энергия ионной решетки — это энергия, необходимая для превращения 1 моль кристаллического вещества в бесконечно удаленные друг от друга газообразные катионы и анионы.
Ионные кристаллы с одноатомными ионами типа NaCl, МgО, Аl2О3 имеют высокие температуры плавления и кипения. Эти температуры тем выше, чем больше энергия кристаллической решетки. При увеличении энергии ионной решетки возрастает и твердость кристаллов. NaСl, MgO и Аl2О3 обладают большой твердостью, но одновременно они характеризуются таким механическим свойством, как хрупкость. Твердость α-Аl2О3 очень велика, и это вещество (корунд) используют в часовых и других механизмах, а также в качестве абразивного материала для обработки твердых материалов.
Ионные кристаллы образуются не только одноатомными ионами. Разнообразные соли и комплексные кристаллические соединения включают многоатомные анионы и катионы, взаимодействующие друг с другом также электростатически. К числу солей с многоатомными ионами относятся соли аммония, нитраты, карбонаты, сульфаты, фосфаты и многие другие.
Кристаллические комплексные соединения настолько многочисленны, что составляют большую часть неорганических соединений. Среди них следует выделить комплексные соединения типа [Аl(Н2О)6]2(S04)3, в которых присутствуют аквакатионы. Нередко сочетание стехиометрии и радиусов многоатомных ионов в подобных соединениях оказывается таким, что в их кристаллах содержится вода, занимающая пустоты кристаллической решетки. Например, сульфат алюминия, помимо 12 молекул воды, образующих координационные сферы катионов Аl3+, может включать еще 6 молекул воды и образовывать кристаллогидрат [Аl(Н2О)6]2(SО4)3 • 6Н2О.
Многоатомные и тем более комплексные ионы имеют гораздо большие радиусы, чем одноатомные ионы. Возрастание межъядерных расстояний в кристаллах со сложными ионами приводит к ослаблению кулоновского взаимодействия. Энергии их кристаллических решеток ниже.
Для ионных кристаллов с многоатомными ионами и кристаллогидратов характерны специфические свойства. Например, кристаллогидрат [Аl(Н2О)6]2(SО4)3 • 6Н2О при 86 °С теряет 6 молекул Н2О и превращается в [Аl(Н2О)6]2(SО4)3. При температурах выше 340 °С это соединение постепенно теряет воду координационных сфер катионов Аl3+ и превращается в безводный Аl2(SО4)3. При 770 °С начинается разложение сульфат-иона, происходящее с выделением SО3 и образованием Аl2О3. Эта последовательность превращений характерна для кристаллогидратов с многоатомными анионами SО42-, N03-, СО32-. Фосфаты, силикаты и некоторые другие анионы при высоких температурах ведут себя иначе. Они образуют полимерные неорганические анионы.
Двойные соли содержат в кристаллах два вида катионов, например гексагидрат сульфата железа(II) -аммония (соль Мора) FеS04 • (NН4)2S04 • 6Н20.
Смешанные соли имеют в кристаллах два вида анионов, например хлорид-бромид серебра АgСl • АgВr.
Связь в кристаллических металлах. Структурной единицей кристаллической решетки металлов является атом. Самые распространенные кристаллические решетки металлов — это уже рассмотренные кубическая гранецентрированная и гексагональная решетки, а также кубическая объёмно-центрированная решетка (нарисовать рисунок). 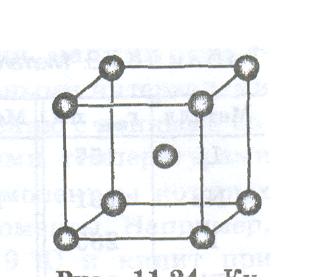
В кубической объёмно-центрированной решетке каждый атом металла окружен восемью равноценными ему, а в двух других -двенадцатью. Таким образом, каждый из атомов может образовывать со своими непосредственными соседями 8 или 12 связей, располагая для этого обычно небольшим числом валентных электронов. В этих условиях возникает большое число многоцентровых орбиталей с малым числом электронов на них. Орбитали охватывают значительное число атомов, они делокализованы. Электроны на этих орбиталях обобществлены сразу многими атомами.
Эта картина строения металлов очень близка к такому качественному представлению: кристаллические решетки металлов образуются положительно заряженными катионами и «погружены» в электронный газ. Валентные электроны в пределах металлического кристалла перемещаются почти свободно. Электронный газ компенсирует силы электростатического отталкивания положительных ионов и является причиной термодинамической и механической устойчивости металлического состояния. Концентрация свободных электронов в электронном газе металлов составляет 1022—1023 электронов в 1 см3.
Представление об электронном газе позволяет объяснить специфические свойства металлического состояния, а именно, высокие электрическую проводимость и теплопроводность, металлический блеск. Электроны электронного газа очень легко перемещаются в металле под действием разности потенциалов. Высокая теплопроводность металлов обусловлена способностью электронов переносить кинетическую энергию. Металлический блеск есть следствие способности электронного газа хорошо отражать световые волны.
Металлы в целом характеризуются пластичностью, а многие из них также прочностью и часто высокими температурами плавления и кипения. Эти свойства также определяются особенностями многоцентровой металлической связи.
Пластичность металлов — проявление легкости изменения многоцентровых связей. Многоцентровый характер связей придает металлам также способность легко перестраивать свои кристаллические решетки с сохранением большого числа таких связей. При повышении температуры в большинстве металлов происходит перестройка структуры кристаллической решетки. Например, у кобальта при комнатной температуре устойчива гексагональная α-модификация, которая при 427 °С переходит в кубическую гранецентрированную δ-модификацию, существующую вплоть до температуры плавления.
Высокие или низкие температуры плавления и кипения металлов определяются прочностью металлических связей. Мерой прочности связей в металлах служит энергия атомизации, т. е. энергия, необходимая для превращения 1 моль металла в атомный пар. Эта энергия изменяется от 76,6 кДж/моль у цезия (tпл = 28,5 °С, tкип = 690 °С) до 851 кДж/моль у вольфрама (tпл = 3387 °С, tкип = 5927 °С). Понятие энергии связи к металлическим связям не применяется из-за их многоцентровой природы.
Половину кратчайшего расстояния между ядрами атомов в кристаллической структуре металла называют металлическим радиусом гмет.
Молекулярные кристаллы. Структурными единицами кристаллических решеток молекулярных кристаллов являются электронейтральные молекулы. Взаимное притяжение молекул в кристаллах обусловлено или слабыми ван-дер-ваалъсовыми силами, или водородными связями, которые гораздо слабее сил, действующих в ионных и металлических кристаллах. Вещества, образующие молекулярные кристаллы, обладают очень низкими температурами плавления и кипения, малыми разностями t пл – t кип, т. е. небольшими температурными интервалами существования жидкого состояния по сравнению с ионными соединениями и металлами. Особенно низкими температурами плавления и кипения обладают вещества, молекулы которых имеют нулевые электрические дипольные моменты. Например, кислород О 2 становится жидким при -219 °С и кипит при -183 °С. Озон О3, молекула которого обладает малым электрическим дипольным моментом, имеет более высокие температуры фазовых переходов и более широкий интервал существования в виде жидкости: tпл = -193 °С, tкип = -112 °С. Увеличение размеров молекулы и особенно ее электрического дипольного момента приводит к росту температур плавления и кипения вещества. Например, температуры кипения метана СН4, пропана С3Н8 и имеющего значительный электрический дипольный момент формальдегида СН2О равны: tкип (СН4) = -162 °С, tкип(С3Н8) = -42 °С, tкип (СН2О) = -19 °С. Вещества, молекулы которых способны образовывать водородные связи, имеют гораздо более высокие температуры плавления и кипения, чем вещества, молекулы которых сравнимы по размерам, но не образуют этих связей. Например, температура кипения воды на 262 °С выше, чем температура кипения метана.
Кристаллические структуры молекулярных кристаллов с ван-дер-ваальсовыми силами взаимодействия подчиняются принципу плотнейшей упаковки. Примером осуществления подобной упаковки является гранецентрированная кристаллическая решетка СО2 («сухого» льда), показанная на рис. (показать рисунок).
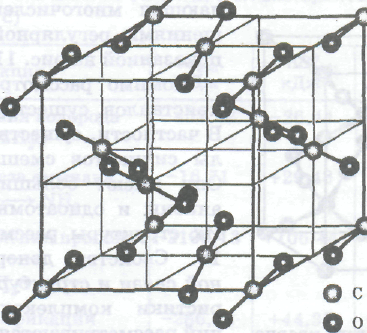
Гранецентрированная молекулярная решетка кристаллического CO2
Каркасные кристаллы. Свойства веществ с каркасными кристаллами очень сильно отличаются от свойств молекулярных кристаллов. Связь в каркасных кристаллах может быть чисто ковалентной, как в алмазе и графите, и может обладать заметной полярностью, как связь Si — О, существующая в кварце. На рис. (показать рисунок) изображена структура кварца. Она близка к структуре алмаза и отличается от нее только тем, что между двумя любыми атомами кремния на равных расстояниях от них всегда находится атом кислорода.
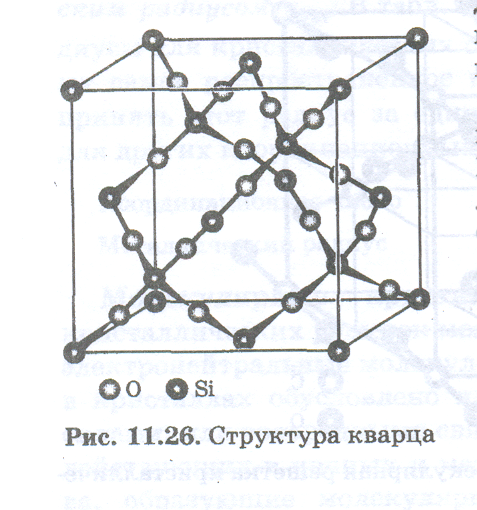
Каркас, образуемый связями Si —О в кварце, является пространственным (трехмерным) и бесконечным. Поэтому нельзя говорить о существовании в кристалле кварца молекулы SiO2. Плавление и тем более испарение каркасных кристаллов может происходить только ценой разрыва химических связей. Поэтому температуры плавления и кипения у веществ с каркасными кристаллами очень велики. Высокой является также прочность каркасных кристаллов. Алмаз и кварц относятся к числу наиболее твердых веществ.
Особенностью каркасных кристаллов с гибкими малополярными связями является отсутствие у них определенной температуры кристаллизации из расплава. При охлаждении расплава кварца образуется стекловидная форма этого вещества, обладающая многочисленными нарушениями регулярной структуры, показанной на рис..
Помимо рассмотренных типов кристаллов, существуют и другие. В частности, существуют кристаллы силикатов смешанного типа. Они имеют большие каркасные анионы и одноатомные катионы.
Date: 2015-09-18; view: 943; Нарушение авторских прав