
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гибридизация атомных орбиталей и геометрия молекул
|
|
Геометрия молекулы — это взаимное пространственное расположение ее атомов, которое определяется длинами связей и валентными углами. От геометрии молекулы зависят физические и химические свойства вещества. Представления метода валентных связей позволяют объяснить геометрию многих молекул. Например, элементы VIА-подгруппы в основном состоянии имеют по два неспаренных р-электрона. Вследствие электростатического отталкивания два р-облака всегда располагаются перпендикулярно друг другу (рис. показать, а). При образовании молекул водородных соединений Н2S, Н2Sе, Н2Тер-облака атомов элементов VIА-подгруппы перекрываются с S-облаками атомов водорода, образуя две ковалентные связи, угол между которыми близок к 90°. Исключение составляет молекула воды, у которой угол НОН равен 104, 5°.
Из рис показать, б видно, что близки к 90е и углы в молекулах водородных соединений элементов VА-подгруппы (РН3, АsН3, 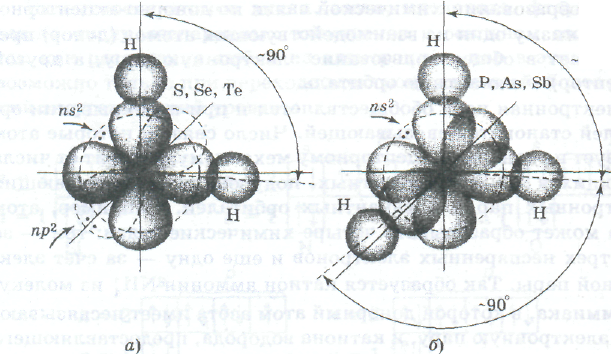
Схема перекрывания электронных облаков в молекулах соединений водорода с серой, селеном, теллуром (а), с фосфором, мышьяком и сурьмой (б):
пунктирными линиями изображены орбитали пs и пр, на которых находятся несвязывающие электронные пары
SЬН3), что хорошо согласуется с взаимным расположением трех р-орбиталей, занятых неспаренными электронами. И в этой подгруппе также есть исключение. Это молекула аммиака, у которой углы НNН равны 107,78°.
Труднее объяснить с помощью метода валентных связей геометрию молекул, образуемых водородом с элементами подгруппы IVА. Атомы этих элементов в возбужденном состоянии имеют по четыре неспаренных электрона: один на s-орбитали и три на р-орбиталях. При образовании гидридов СН4, SiH4, GеН4, SnН4 возникают четыре ковалентные связи. Три из них должны быть s — р-связями, образованными за счет перекрывания р-облаков элементов четвертой группы и s-облаков водорода. Эти связи должны иметь равную длину, энергию и располагаться под углами 90° друг к другу. Четвертая связь должна осуществляться за счет перекрывания s-облака атома углерода и s-облака атома водорода. В результате этого перекрывания должна образовываться связь, отличающаяся от трех других длиной и энергией и расположенная к любой из s — р-связей под углом около 125°. Однако точно установлено, что молекулы водородных соединений элементов подгруппы IV А имеют форму тетраэдра с углом между связями 109,5°, причем все связи равноценны по длине и энергии.
Таким образом, структуру молекул водородных соединений элементов IV А-подгруппы, воды, аммиака и многих других молекул невозможно объяснить исходя только из положений метода валентных связей. Для объяснения геометрии этих молекул привлекается концепция гибридизации атомных орбиталей. Суть концепции гибридизации атомных орбиталей заключается в том, что атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов и, следовательно, наибольший выигрыш энергии. Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей.
sр-Гибридизация. Рассмотрим в качестве примера гибридизацию одной s-орбитали и одной р-орбитали атома Ве. Составим гибридные волновые функции из атомных s- и р- волновых функций:
Ѱs+p=Ѱs+Ѱp,
Ѱs-p=Ѱs-Ѱp
Число гибридных орбиталей равно суммарному числу исходных орбиталей. 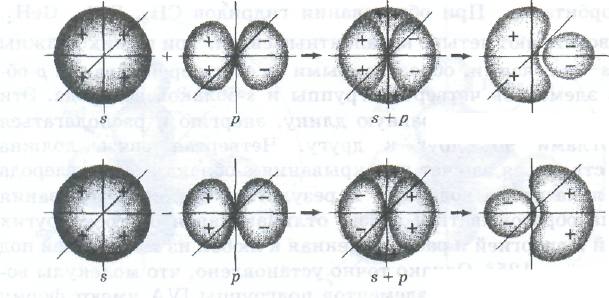
Графическое изображение образования двух гибридных sр-орбиталей в результате линейной комбинации s- и p-орбиталей: а — негибридизованные s- и р-орбитали одного и того же атома, для наглядности показанные раздельно; б -— те же негибридизованные орбитали в том виде, как они располагаются относительно ядра атома (обратите внимание на знак волновой функции); в — две sр-гибридные орбитали одного и того же атома, для наглядности показанные раздельно
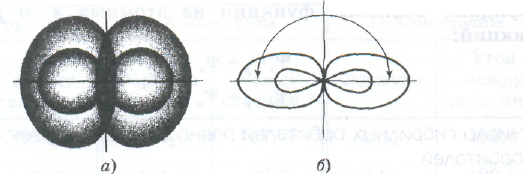
Взаимное расположение в пространстве двух sр-орбиталей одного атома:
а — поверхности, охватывающие области пространства, где вероятность пребывания электрона составляет 90%; б — условное изображение
Графически линейную комбинацию s- и р-орбиталей можно изобразить схемой, приведенной на рис .(показать рисунок).
Два образующихся гибридных sp-электронных облака имеют асимметричную форму, которая обеспечивает большее перекрывание с электронными облаками других атомов, чем перекрывание, возникающее с участием чистых негибридизированных s-и р-облаков. Тем самым гибридизация электронных облаков приводит к выигрышу энергии в результате образования более прочных химических связей. Этот выигрыш в энергии покрывает и затраты энергии на гибридизацию.
Два гибридных sр-облака в результате взаимного отталкивания располагаются относительно ядра атома таким образом, что угол между ними составляет 180° (нарисовать рисунок).
В результате такого расположения гибридных облаков молекулы состава АХ2, где А является центральным атомом, имеют линейную конфигурацию, т. е. ядра всех взаимодействующих атомов располагаются на одной прямой. Например, находятся в состоянии sр-гибридизации валентные электронные орбитали атома бериллия в линейной молекуле ВеСl2 (нарисовать рис.). Линейную конфигурацию вследствие sр-гибридизации валентных электронных орбиталей имеют также молекулы ВеВг2, Ве(СН3)2, ZnСl2, СО2 и ряд других.
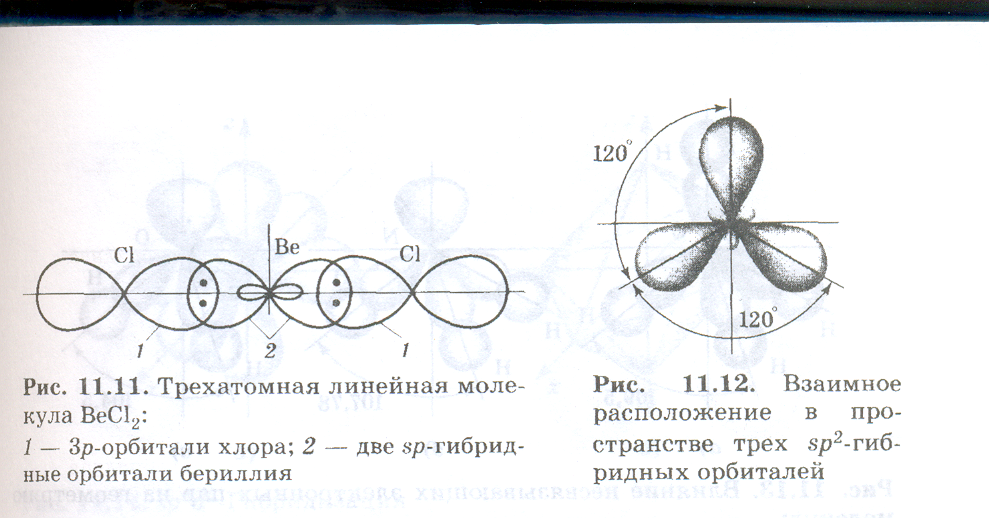
В результате такого расположения гибридных облаков молекулы состава АХ2, где А является центральным атомом, имеют линейную конфигурацию, т. с. ядра всех взаимодействующих атомов располагаются на одной прямой. Например, находятся в состоянии sр-гибридизации валентные электронные орбитали атома бериллия в линейной молекуле ВеСl2 (нарисовать рис.). Линейную конфигурацию вследствие sр-гибридизации валентных электронных орбиталей имеют также молекулы ВеВг2, Ве(СН3)2, ZnСl2, СО2 и ряд других.
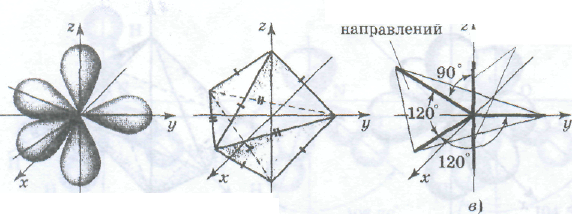
sp2 -Гибридизация. Рассмотрим гибридизацию одной s-орбитали и двух р-орбиталей. В этом случае в результате линейной комбинации трех исходных орбиталей возникают три гибридные sр2-орбитали. Они располагаются в одной плоскости под углом 120° друг к другу (нарисовать рис.). sр2-Гибридизация характерна для многих соединений бора, который, как было показано выше, имеет в возбужденном состоянии три неспаренных электрона: один s- и два р-электрона. При перекрывании sр2-орбиталей атома бора с орбиталями других атомов образуются три связи, равноценные по длине и энергии. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sр2-гибридизации, имеют форму плоского треугольника. Углы между связями равны 120°. В состоянии sр2-гибридизации находятся валентные орбитали атомов бора в молекулах ВF3, ВСl3, атомов углерода и азота в анионах СО32-, NO3-.
sp3-Гибридизация. Очень большое распространение имеют молекулы, в которых центральный атом содержит четыре sр3-орбитали, образующиеся в результате линейной комбинации одной s-орбитали и трех р-орбиталей. Четыре sр3-орбитали располагаются под углом 109,5° друг к другу. Они направлены
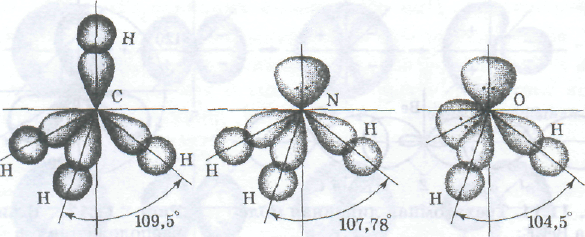
а) б) в)
Влияние несвязывающих электронных пар на геометрию
молекул:
а — метан, несвязывающих электронных пар нет; б — аммиак, одна несвязывающая электронная пара; в -- вода, две несвязывающие пары
к вершинам тетраэдра, в центре которого находится ядро атома (рис. а).
Образование четырех равноценных химических связей за счет перекрывания sp3-орбиталей с орбиталями других атомов характерно для атома углерода (СН4, СF4, ССl4), что очень важно в органической химии. Тетраэдрическую структуру имеют также молекулы других соединений элементов подгруппы IVА; SiH4, GеН4, SiF4, SiВr4, GеСl4 и т. п.
Неподеленные электронные пары гибридных орбиталей. Вовсех рассмотренных примерах гибридные орбитали были заселены неспаренными электронами. Однако нередки случаи, когда гибридная орбиталь занята несвязывающей электронной парой. Это оказывает влияние на геометрию молекул. Поскольку несвязывающая электронная пара испытывает воздействие ядра только своего атома, а связывающие пары находятся под действием двух ядер, несвязывающая электронная пара находится ближе к ядру, чем связывающие. В результате этого несвязывающая электронная пара сильнее отталкивает связывающие электронные пары, чем те отталкивают друг друга. Графически для наглядности большую отталкивающую силу, действующую между несвязывающей электронной парой и связывающими электронными парами, можно изобразить большим по объему электронным облаком несвязывающей пары. Несвязывающая электронная пара имеется, например, у атома азота в молекуле аммиака (рис. б). В результате взаимодействия со связывающими парами углы между связями Н—N — Н сокращаются до 107,78° по сравнению со 109,5o характерными для правильного тетраэдра.
Еще большее отталкивание испытывают связывающие электронные пары в молекуле воды, где у атома кислорода имеются две несвязывающие электронные пары. В результате этого угол Н—О —Н в молекуле воды равен 104,5° (рис. в).
Рис. sp3d2-Гибридизация
|
Если несвязывающая электронная пара в результате образования донорно-акцепторной связи превращается в связывающую, то силы отталкивания между этой новой связью и другими связями в молекуле становятся одинаковыми, выравниваются и углы между связями. Это происходит, например, при образовании катиона аммония из молекулы аммиака.
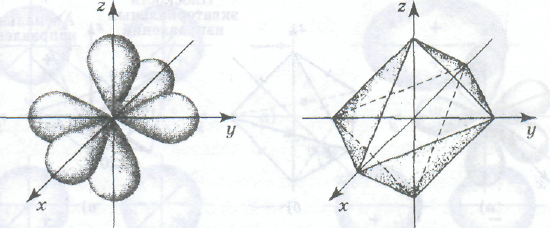
Участие в гибридизации d-орбиталей. Если энергии орбиталей одного из d-подуровней атома не очень сильно отличаются от энергий s- и р-орбиталей, то d-орбитали также могут участвовать в гибридизации. Самым распространенным типом гибридизации с участием d-орбиталей является sр3d2-гибридизация, в результате которой образуются шесть равноценных по форме и энергии гибридных облаков (рис. а), направленных к вершинам октаэдра, в центре которого находится ядро атома. Октаэдр (рис. б) — правильный восьмигранник. Все ребра в нем равной длины, все грани — правильные треугольники.
Реже встречается sp3d-гибридизация, в результате которой образуются пять гибридных облаков (рис. а), направленных к вершинам тригональной бипирамиды (рис. б). Тригональная бипирамида — это две равнобедренные пирамиды, соединенные общим основанием. Основание -- правильный треугольник. Полужирными штрихами на рис. б
Date: 2015-09-18; view: 2208; Нарушение авторских прав