
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Порядок связи равен разности чисел электронов на связывающих и разрыхляюших орбиталях, деленной на два
|
|
В молекуле водорода порядок связи ω равен единице:
ω = 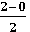 =1
=1
Энергетическую диаграмму для молекулярных орбиталей, полученную при рассмотрении молекулы водорода, можно использовать и для анализа возможности существования других двухатомных молекул и ионов элементов первого периода.
Так называемый молекулярный ион водорода H2+ состоит из двух протонов и одного электрона. Этот единственный электрон, переходя с атомной 1s-орбитали на связывающую молекулярную орбиталь, обеспечивает выигрыш энергии, достаточный для стабилизации иона H2+. В данном случае образуется частица, в которой связь обусловлена не электронной парой, а единственным электроном. С помощью метода валентных связей существование такого соединения объяснить нельзя.
В ионе He2+ имеется три электрона. Два из них занимают связывающую орбиталь, а третий находится на разрыхляющей орбитали. На связывающей орбитали электронов больше, чем на разрыхляющей, поэтому ион может существовать.
Двухатомные гомоядерные молекулы. Молекулярные орбитали, возникающие из атомных орбиталей 2s и 2р, образуют следующую «энергетическую лестницу» (рис. а):
σ2s < σ*2s < σ2рх < π2ру = π2рz < π*2рy = π*2рz < σ*2рх.
Атомные орбитали 1s не участвуют в образовании молекулярных.
В приведенной «энергетической лестнице» энергии σ2р-и π2р-орбиталей близки, и их взаимное расположение зависит от заселенности предыдущих орбиталей. Поэтому в молекулах В2, С2, N2 орбиталь σ2рx лежит выше орбиталей π2ру и π2рz. Определим кратности связей и числа неспаренных электронов в гомоядерных, т. е. состоящих из одинаковых атомов, молекулах элементов второго периода. При этом запись молекулярных орбиталей упростим, опустив символы атомных орбиталей, из которых они образуются.
Образование молекулы Li2 из двух атомов Li означает заполнение связывающей оорбитали двумя электронами:
2Li[2s1] →Li2[(σ)2]
Молекула Li2 имеет таким образом одинарную σ-связь. 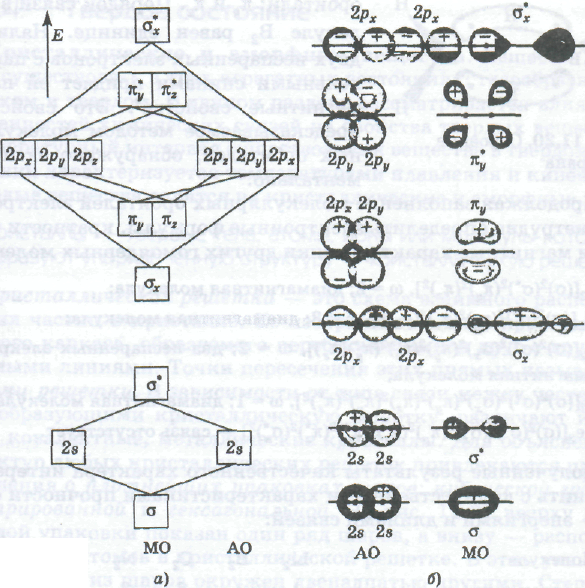
Рис. Энергетическая диаграмма расположения атомных АО и молекулярных МО орбиталей (а) и схема образования молекулярных орбиталей (б) из атомных орбиталей
Молекула Ве2 может образовываться только путем заполнения орбиталей σ и σ* двумя электронными парами:
2Ве[2s2] → Ве2[(σ)2(σ*)2],
но при таком заполнении числа электронов на связывающей и разрыхляющей орбиталях равны, энергия системы не уменьшается, и молекула Ве2 не образуется, что подтверждено экспериментально.
В образовании молекулы В2 участвуют шесть электронов двух атомов бора:
2B[2s22p1] → B2[(σ)2(σ*)2(πy)(πz)]
В молекуле В2, согласно правилу Хунда, два электрона попадают по одному на две энергетически равноценные связывающие орбитали: πy и πz. Порядок связи в молекуле В2 равен единице. Наличие двух неспаренных электронов с параллельными спинами придает ей парамагнитные свойства*. Это свойство, предсказываемое методом молекулярных орбиталей, обнаружено экспериментально.
Продолжая заполнение молекулярных орбиталей электронами, нетрудно определить электронные формулы, кратности связей и магнитные характеристики других гомоядерных молекул:
С2[(σ)2(σ *)2(πy)2(πz)2], ω=2; диамагнитная молекула;
N2[(σ)2(σ*)2(πy)2 (πz)2(σx)2], ω = 3; диамагнитная молекула;
O2 [(σ)2(σ*)2 (σх)2(πy)2 (πz)2(π*y) (π*z)], ω = 2; два неспаренных элекрона, парамагнитная молекула;
F2 [(σ)2(σ*)2 (σх)2(πy)2 (πz)2(π*y) 2 (π*z) 2], ω = 1; диамагнитная молекула;
Ne2 [(σ)2(σ*)2 (σх)2(πy)2 (πz)2(π*y) 2 (π*z) 2(σx)2] — связь отсутствует.
Представление о многоцентровых молекулярных орбиталях. Молекула диборана В2Н6 относится к числу электронодефицитных. Число электронов, участвующих в образовании связей, меньше удвоенного числа связей. Четыре концевые связи В—Н, лежащие в плоскости, перпендикулярной плоскости рисунка (рис.), являются обычными двухэлектронными. Группы же ВНВ, лежащие в плоскости рисунка, связываются трехцентровыми связями с одной электронной парой на каждой такой орбитали. У каждого из атомов бора благодаря этим орбиталям возникает тетраэдрическое окружение из четырех атомов Н.

Date: 2015-09-18; view: 1036; Нарушение авторских прав