
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Атомное ядро
|
|
Ядро каждого атома или иона состоит из N нейтронов и Z протонов, условные обозначения и характеристики которых даны ранее. Нейтроны и протоны — элементарные частицы, имеющие массу около 1 а. е. м.: тn = 1,0087 а. е. м., тp = 1,0078 а. е. м. (Напомним, что 1 а. е. м. = 1/12 массы изотопа углерода 126С. В атомной системе единиц, которой мы пользовались выше, тn — 1838, 8те и тp = 1836, 1 те, где масса покоя электрона принималась равной единице). Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Поскольку и протон, и нейтрон имеют массу, очень близкую к атомной единице массы, то массовое число атома приближенно выражает его атомную массу. Но число протонов равно числу положительных зарядов, т. е. порядковому номеру элемента; следовательно, число нейтронов равняется разности между массовым числом и порядковым номером элемента. Запись каждого элемента AZЭ (например, для хлора 3617Сl, железа 5626Fе) характеризуется не только указанием его символа, но и характеристик ядра его атома: А = N + Z — массового числа и Z — заряда ядра. Конкретное ядро с данным массовым числом А и данным зарядом Z называется нуклидом. Масса ядра тя всегда меньше, чем масса всех составляющих его протонов и нейтронов. Разность называется дефектом массы. Сумма масс протонов и нейтронов, образующих ядро гелия, равна
2 - 1,00728 + 2 - 1,00867 = 4,03190,
тогда как в действительности масса ядра гелия равна 4,0026, т. е. примерно на 0,03 а. е. м. меньше. Аналогичные результаты получаются при подсчете масс других ядер.
Чем же объяснить уменьшение массы при образовании атомных ядер? Как уже неоднократно упоминалось, из теории относительности вытекает связь между массой и энергией, выражаемая уравнением Эйнштейна Е = тс2. Из этого уравнения следует, что каждому изменению массы должно отвечать и соответствующее изменение энергии. Если при образовании атомных ядер происходит заметное уменьшение массы, это значит, что одновременно выделяется огромное количество энергии. Дефект массы при образовании ядра атома гелия составляет 0,03 а. е. м., а при образовании 1 моля атомов гелия — 0,03 г. Согласно уравнению Эйнштейна, это соответствует выделению 2,7 - 1012 Дж энергии. Чтобы составить себе представление о колоссальной величине этой энергии, достаточно указать, что она примерно равна той энергии, которую может дать в течение часа электростанция, равная по мощности Днепрогэсу.
Энергия связи ядра, рассчитываемая по выражению Эйнштейна Е = тс2, определяет устойчивость ядра: чем больше величина выделившейся энергии, тем устойчивее ядро.
Нуклоны (нейтроны и протоны) распределены приблизительно равномерно по объему ядра. Между образующими ядро частицами действуют два вида сил: электростатические силы взаимного отталкивания положительно заряженных протонов и силы притяжения между всеми частицами, входящими в состав ядра, называемые ядерными силами. С возрастанием расстояния между взаимодействующими частицами ядерные силы убывают гораздо более резко, чем силы электростатического взаимодействия. Поэтому их действие заметно проявляется только между очень близко расположенными частицами. Но при ничтожных расстояниях между частицами, составляющими атомное ядро, ядерные силы притяжения превышают силы отталкивания, вызываемые присутствием одноименных зарядов, и обеспечивают устойчивость ядер.
Энергия связи ядра приблизительно прямо пропорционально зависит от числа нуклонов, а энергия связи, приходящаяся на один нуклон, имеет максимальное значение при средних атомных массах. Поэтому средние по массе ядра стабильнее, чем ядра более легкие и более тяжелые. При Z > 84 все ядра нестабильные.
Ядра с четными значениями Z и N встречаются гораздо чаще. При этом наиболее устойчивы ядра с количеством нуклонов 2, 8, 14, 20, 28, 50, 82, 126. Эти числа получили название магических и связаны с тем, что, как и для электронов в атоме, для ядер справедлив принцип заполнения оболочек с особенно устойчивыми конфигурациями.
Радиоактивность. Сведения об устойчивости атомных ядер получаются при исследовании явления радиоактивности. При этом распад ядер сопровождается излучением: α-излучение — ядра гелия 42Не (ион Не2+), β-излучение — поток электронов высокой энергии, γ-излучение — электромагнитные волны более высокой частоты, чем рентгеновское излучение.
Радиоактивные элементы и их распад. Радиоактивностью называется самопроизвольное превращение неустойчивого изотопа (изотопы – ядра, имеющие одинаковые числа протонов) одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер. Радиоактивность, проявляемая природными изотопами элементов, называется естественной радиоактивностью. Процессы радиоактивных превращений протекают у разных изотопов с различной скоростью. Эта скорость характеризуется постоянной радиоактивного распада, показывающей, какая часть общего числа атомов радиоактивного изотопа распадается в 1 с. Чем больше радиоактивная постоянная, тем быстрее распадается изотоп.
Изучение процессов радиоактивного распада показало, что количество атомов радиоактивного изотопа, распадающихся в единицу времени, пропорционально имеющемуся в данный момент общему количеству атомов этого изотопа. Другими словами, всегда распадается одна и та же часть имеющегося числа атомов. Таким образом, если в течение некоторого времени разложилась половина имевшегося радиоактивного изотопа, то в следующий такой же промежуток времени разложится половина остатка, т. е. вдвое меньше, еще в следующий — вдвое меньше, чем в предыдущий, и т. д. Наблюдая, например, за изменением количества радона, установили, что через 3,85 суток остается половина первоначального количества, еще через 3,85 суток — только 1/4, затем 1/8 и т. д.
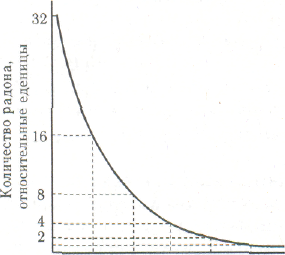
|
Зависимость количества нераспавшегося радона от времени показана на рис. (нарисовать рисунок)
Промежуток времени, в течение которого разлагается половина первоначального количества радиоактивного элемента, называется периодом полураспада. Эта величина характеризует продолжительность жизни элемента. Для различных радиоактивных элементов она колеблется от долей секунды до миллиардов лет. Так, период полураспада радона составляет 3,85 суток, радия — 1620 лет, урана — 4,5 миллиарда лет.
К основным видам радиоактивного распада относятся α-распад, β-распад, электронный захват и спонтанное деление. Часто эти виды радиоактивного распада сопровождаются испусканием γ-лучей, т.е. жесткого (с малой длиной волны) электромагнитного излучения.
При α -распаде ядро атома испускает два протона и два нейтрона, связанные в ядро атома гелия 42Не; это приводит к уменьшению заряда исходного радиоактивного ядра на 2, а его массового числа на 4. Таким образом, в результате α -распада образуется атом элемента, смещенного на два места от исходного радиоактивного элемента к началу периодической системы.
Возможность β-распада связана с тем, что протон и нейтрон представляют собой два состояния одной и той же элементарной частицы — нуклона (от латинского nuclеиs — ядро). При известных условиях (например, когда избыток нейтронов в ядре приводит к его неустойчивости) нейтрон может превращаться в протон, одновременно «рождая» электрон. Этот процесс можно изобразить схемой:
Нейтрон → Протон + Электрон или п → р+ е-.
При взаимопревращениях протона и нейтрона образуются также другие элементарные частицы (нейтрино и антинейтрино). Поскольку масса покоя и электрический заряд этих частиц равны нулю, их участие в радиоактивных превращениях в приводимых здесь схемах не отражено.
Таким образом, при β-распаде один из нейтронов, входящих в состав ядра, превращается в протон; возникающий при этом электрон вылетает из ядра, положительный заряд которого на единицу возрастает.
Возможно также превращение протона в нейтрон с образованием позитрона:
Протон → Нейтрон +Позитрон илиp→n + e+
Такой процесс может происходить в тех случаях, когда неустойчивость ядра вызвана избыточным содержанием в нем протонов, При этом один из протонов, входящих в состав ядра, превращается в нейтрон, возникающий позитрон вылетает за пределы ядра, а заряд ядра на единицу уменьшается. Такой вид радиоактивного распада называется позитронным β-распадом (или β+-распадом) в отличие от ранее рассмотренного электронного β -распада (β—распада).
Этот вид радиоактивного превращения наблюдается у некоторых искусственно полученных радиоактивных изотопов.
Изменение заряда ядра при β-распаде приводит к тому, что в результате β-распада образуется атом элемента, смещенного на одно место от исходного радиоактивного элемента к концу периодической системы (в случае β--распада) или к ее началу (в случае β+-распада).
К уменьшению заряда ядра на единицу при сохранении массового числа атома приводят не только β+-распад, но и электронный захват, при котором один из электронов атомной электронной оболочки захватывается ядром; взаимодействие этого электрона с одним из содержащихся в ядре протонов приводит к образованию нейтрона:
e- + р → n.
Электрон чаще всего захватывается из ближайшего к ядру K-слоя (K-захват), реже из L- или М -слоев.
Спонтанным делением называется самопроизвольный распад ядер тяжелых элементов на два (иногда на три или на четыре) ядра элементов середины периодической системы. Варианты такого деления очень разнообразны, так что общих правил смещения по периодической системе не существует; чаще всего происходит распад исходного ядра на тяжелый и легкий осколки, несущие соответственно около 60 и 40 % заряда и массы исходного ядра. Относительное содержание нейтронов в ядрах изотопов тяжелых элементов выше, чем в ядрах устойчивых изотопов середины периодической системы. Поэтому при спонтанном делении распадающееся ядро испускает 2—4 нейтрона; образующиеся ядра все еще содержат избыток нейтронов, оказываются неустойчивыми и поэтому претерпевают последовательный ряд β--распадов.
Элементы, расположенные в конце периодической системы (после висмута), не имеют стабильных изотопов. Подвергаясь радиоактивному распаду, они превращаются в другие элементы. Если вновь образовавшийся элемент радиоактивен, он тоже распадается, превращаясь в третий элемент, и так далее до тех пор, пока не получаются атомы устойчивого изотопа. Ряд элементов, образующихся подобным образом один из другого, называется радиоактивным рядом. Примером может служить приводимый ниже ряд урана — последовательность продуктов превращения изотопа 23892U составляющего преобладающую часть природного урана; для каждого превращения указан тип радиоактивного распада (над стрелкой) и период полураспада (под стрелкой) (показать картинку)
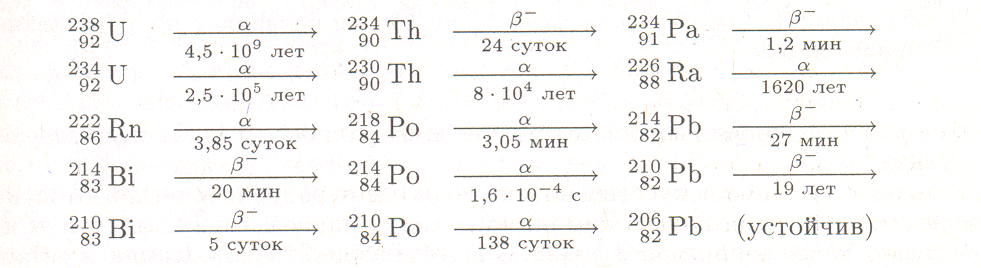
Таким образом, конечным продуктом распада является устойчивый изотоп свинца.
При β-распаде массовое число изотопа не меняется, а при α-распаде уменьшается на 4. Поэтому возможно существование четырех радиоактивных рядов: один из них включает изотопы, массовые числа которых выражаются общей формулой 4n (n — целое число), второму отвечает общая формула массового числа 4n + 1, третьему — 4n + 2 (это и есть радиоактивный ряд урана) и четвертому — 4n + 3. Действительно, помимо ряда урана, известны еще два естественных радиоактивных ряда: ряд тория, начинающийся с изотопа 23290Th и соответствующий общей формуле массового числа 4n, и ряд актиния, начинающийся с изотопа 23592U и отвечающий общей формуле массового числа 4n + 3. Устойчивые продукты превращений в этих рядах тоже представляют собой изотопы свинца 20882Рb и 20782Рb. Родоначальником четвертого радиоактивного ряда (ряда нептуния) с общей формулой массового числа 4п + 1 служит изотоп искусственно полученного элемента нептуния 23793Np; здесь конечным продуктом распада является устойчивый изотоп висмута 20983Вi.
Накопление свинца в результате распада содержащихся в минералах радиоактивных элементов позволяет определить возраст соответствующих горных пород, Зная скорость распада 23892U, 23290Th и 23592U и определив их содержание, а также содержание и изотопный состав свинца в минерале, можно вычислить возраст минерала, т. е. время, прошедшее с момента его образования (так называемый свинцовый метод определения возраста). Для минералов с плотной кристаллической упаковкой, хорошо сохраняющей содержащиеся в кристаллах газы, возраст радиоактивного минерала можно установить по количеству гелия, накопившегося в нем в результате радиоактивных превращений (гелиевый метод). Для определения возраста сравнительно молодых образований (до 70 тыс лет) применяется радиоуглеродный метод, основанный на радиоактивном распаде изотопа углерода 146С (период полураспада около 5600 лет). Этот изотоп образуется в атмосфере под действием космического излучения и усваивается организмами, после гибели которых его содержание убывает по закону радиоактивного распада. Возраст органических остатков (ископаемые организмы, торф, осадочные карбонатные породы) может быть определен путем сравнения радиоактивности содержащегося в них углерода с радиоактивностью углерода атмосферы.
Искусственная радиоктивность. Оказалось, что некоторые легкие элементы, например бор, магний, алюминий, при «бомбардировке» α-частицами испускают позитроны. Причем испускание позитронов продолжается некоторое время после воздействия α-частиц. Значит, при бомбардировке α-частицами образуются радиоактивные атомы, обладающие определенной продолжительностью жизни, но испускающие не α-частицы и не электроны, а позитроны. Таким образом, была открыта искусственная радиоактивность.
Например, в случае алюминия процесс протекает в две стадии
2713Al + 42He → 3015P + n,
где 3015P — искусственно полученный изотоп фосфора — радиофосфор. Последний неустойчив (период полураспада 3 мин 15 с) и распадается с образованием устойчивого ядра:
3015P →3014Si+ е+.
Аналогичные процессы происходят при бомбардировке α-частицами ядер бора и магния.
В настоящее время искусственно получены сотни радиоактивных изотопов химических элементов. Раздел химии, изучающий радиоактивные элементы и их поведение, называется радиохимией. Следует различать радиохимию и радиационную химию, предметом которой являются химические процессы, протекающие под действием ионизирующих излучений.
Получение изотопа 3015P путем бомбардировки атомов алюминия а-частицами служит примером ядерных реакций, под которыми понимают взаимодействие ядер с элементарными частицами (нейтронами п, протонами р, γ-фoтонами) или с другими ядрами (например, с α-частицами или дейтронами 21Н). С протеканием ядерных реакций связаны происхождение элементов, возможность их искусственного взаимопревращения и синтеза новых элементов.
Для осуществления ядерной реакции бомбардирующая частица должна обладать большой энергией. Разработаны и созданы специальные установки (ускорители). позволяющие сообщать заряженным частицам огромную энергию. Для проведения ядерных реакций используются также потоки нейтронов, образующиеся при работе атомных реакторов. Применение этих мощных средств воздействия на атомы позволило осуществить большое число ядерных превращений.
Таким образом был искусственно получен неизвестный до этого элемент с порядковым номером 43, заполнивший соответствующее место в периодической системе и получивший название технеция (Тс). Для этого молибден бомбардировали дейтронами:
9842Mo + 21H → 9943Tc + n.
Особый интерес представил синтез ряда трансурановых элементов, расположенных в периодической системе после урана. При поглощении нейтронов ядрами изотопа 23892U образуется β- радиоактивный изотоп урана 23992U периодом полураспада 23 мин. Испуская β -частицы, 23992U превращается в новый элемент -нептуний 23993Np. Было установлено, что 23993Np тоже радиоактивен. Подвергаясь β--распаду, он превращается в элемент с порядковым номером 94- 23994Pu -плутоний (Рu). К настоящему времени искусственным путем получены тяжелые элементы вплоть до элемента с порядковым номером 109 — мейтнерия.
Изучение ядерных реакций открыло путь к практическому использованию внутриядерной энергии. Оказалось, что наибольшая энергия связи нуклонов в ядре (в расчете на один нуклон) отвечает элементам средней части периодической системы. Это означает, что как при распаде ядер тяжелых элементов на более легкие (реакции деления), так и при соединении ядер легких элементов в более тяжелые ядра (реакции термоядерного синтеза,) должно выделяться большое количество энергии.
Первая ядерная реакция, которую применили для получения энергии, представляет собой реакцию деления ядра 23592Uпод действием проникающего в ядро нейтрона. При этом образуются два новых ядра — осколка близкой массы, испускается несколько нейтронов (так называемые вторичные нейтроны) и освобождается огромная энергия: при распаде 1 г 23592Uвыделяется 7,5 × 107 кДж. т. е. больше, чем при сгорании 2 т каменного угля. Вторичные нейтроны могут захватываться другими ядрами 23592U и, в свою очередь, вызывать их деление. Таким образом, число отдельных актов распада прогрессивно увеличивается, возникает цепная реакция деления ядер урана.
Не все вторичные нейтроны участвуют в развитии этого цепного процесса: некоторые из них успевают вылететь за пределы куска урана, не успев столкнуться с ядром способного к делению изотопа. Поэтому в небольшом куске урана начавшаяся цепная реакция может оборваться: для ее непрерывного продолжения масса куска урана должна быть достаточно велика, не меньше так называемой критической массы. При делении урана цепной процесс может приобрести характер взрыва: именно это и происходит при взрыве атомной бомбы. Для получения же управляемой реакции деления необходимо регулировать скорость процесса, меняя число нейтронов, способных продолжать реакцию. Это достигается введением в реакционный объем стержней, содержащих элементы, ядра которых интенсивно поглощают нейтроны (к подобным элементам принадлежит, например, кадмий).
Кроме 23592U для получение ядерной энергии используют плутоний 23994Pu, синтезируемый из 23892U, и изотоп урана 23392U, получаемый из природного изотопа тория 23290Th:
23290Th + n→ 23390Th; 23390Th→ 23391Pa + β-; 23391Pa→ 23392U+ β-.
Изотопы 23994Pu и 23392U подобно изотопу 23592U, захватывая нейтрон, подвергаются делению.
Реакция ядерного синтеза также может служить источником энергии. Так, при образовании ядра атома гелия из ядер дейтерия и трития
21Н + 31Н → 42Не + n
на каждый грамм реакционной смеси выделяется 35 • 107 кДж, т. е. почти в 5 раз больше, чем при распаде 1 г 23592U. Превращение имеющихся на Земле запасов дейтерия (около 4 • 1013 т) в гелий могло бы поэтому стать практически неисчерпаемым источником энергии для человечества. Однако для проведения реакций ядерного синтеза подобного типа (термоядерных реакций) необходима очень высокая температура (свыше 1 млн градусов). Пока удалось осуществить только неуправляемую термоядерную реакцию, приводящую к взрыву огромной мощности: на этом процессе основано действие водородной бомбы. В настоящее время проводятся интенсивные исследования, ставящие целью овладение управляемым процессом термоядерного синтеза.
Date: 2015-09-18; view: 1220; Нарушение авторских прав