
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Метод молекулярных орбиталей
|
|
Основное положение. Этот метод предполагает, что при образовании химической связи из атомных орбиталей (АО) возникают молекулярные орбитали (МО). Условием образования химической связи в методе молекулярных орбиталей является уменьшение энергии системы атомов при переходе электронов с атомных на молекулярные орбитали.
Разница между атомной и молекулярной орбиталями заключается в том, что атомная орбиталь принадлежит ядру одного атома, и поэтому является одноцентровой орбиталью, а молекулярная орбиталь принадлежит сразу двум или нескольким ядрам, и поэтому является двух- или гораздо чаще многоцентровой орбиталью. Центрами молекулярных орбиталей являются ядра атомов молекулы. Таким образом, электроны, находящиеся на
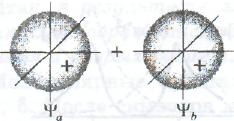

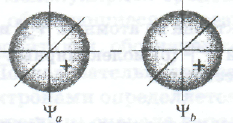

Рис. Образование связывающей Ѱ, разрыхляющей Ѱ’ молекулярных σ-орбиталей в результате сложения (а) и вычитания (б) двух атомных 1s-орбиталей
молекулярных орбиталях, обобществляются двумя, тремя или всеми атомами молекулы, а не только двумя соседними атомами, как это предполагает метод валентных связей. Молекулу в методе молекулярных орбиталей рассматривают как единую частицу, электронное строение которой подобно электронному строению многоэлектронного атома. Волновая функция и энергия каждой молекулярной орбитали так же, как и атомных орбиталей, определяются значениями молекулярных квантовых чисел.
Для построения молекулярных орбиталей обычно пользуются линейной комбинацией атомных орбиталей (ЛКАО), т. е. волновую функцию молекулярной орбитали представляют как алгебраическую сумму двух или нескольких атомных волновых функций. В качестве простейшего примера ЛКАО рассмотрим построение молекулярных орбиталей молекулы водорода из атомных 1s-орбиталей, принадлежащих атомам водорода На и Нb. При линейной комбинации двух атомных волновых функций Ѱa и Ѱb получаются две молекулярные волновые функции:
Ѱ=Ѱa+Ѱb,
Ѱ=Ѱa-Ѱb
Молекулярная волновая функция Ѱ, образующаяся в результате сложения атомных волновых функций, описывает связывающую молекулярную орбиталь (верхний рис. ). Для связывающей моле кулярной
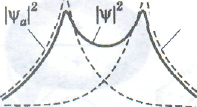

Рис. Вероятность нахождения электрона на атомных |Ѱа|2 и |Ѱb|2> на связывающей |Ѱ|2 (а) и разрыхляющей |Ѱ’|2 (б) молекулярных орбиталях в зависимости от межъядерного расстояния
орбитали характерна большая вероятность обнаружения электронов в пространстве между ядрами (рис. а). Когда электроны находятся в межъядерном пространстве, действуют силы взаимного притяжения между электронами и ядрами, в результате чего энергия системы уменьшается. Таким образом, при нахождении электронов на связывающей молекулярной орбитали полная энергия системы из двух атомов становится меньшей, чем при нахождении электронов на исходных атомных орбиталях. На энергетической диаграмме (рис.) это отражено тем, что связывающая орбиталь располагается ниже соответствующих атомных орбиталей.
Молекулярная волновая функция Ѱ*, образующаяся в результате взаимного вычитания атомных волновых функций, описывает разрыхляющую орбиталь (рис. б). Для разрыхляющей орбитали характерна малая вероятность нахождения электронов в пространстве между ядрами (рис. б). Поэтому при пребывании электронов на разрыхляющей орбитали увеличиваются силы отталкивания между ядрами, в результате чего энергия системы возрастает. На энергетической диаграмме разрыхляющая орбиталь находится выше соответствующих атомных орбиталей (см. рис.).
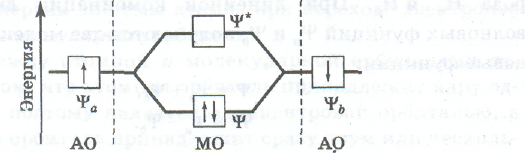
Рис. Энергетическая диаграмма образования молекулярных орбиталей МО молекулы водорода из атомных орбиталей АО двух атомов водорода
Итак, в результате линейной комбинации двух атомных орбиталей образуются две молекулярные орбитали: связывающая и разрыхляющая.
Молекулярные орбитали обозначают греческими буквами: σ, π, δ. После символов молекулярных орбиталей записывают символы атомных орбиталей, участвующих в образовании данной молекулярной орбитали. Например, молекулярные орбитали, образующиеся в результате линейной комбинации двух 1s-орбиталей, обозначаются так: σ1s и σ*1s.
Последовательность заполнения молекулярных орбиталей электронами определяется, как и в атомах, принципом минимума энергии: сначала заполняется та орбиталь, которой соответствует наиболее низкая энергия, затем — орбитали с большими значениями полной энергии. Максимальное число электронов на любой молекулярной орбитали определяется, как и в атоме, принципом Паули. В соответствии с этим принципом в молекуле водорода оба электрона находятся на связывающей орбитали. Так как нахождение электронов на связывающей орбитали приводит к уменьшению энергии системы, молекула водорода устойчива.
Вместо понятия «валентность», используемого в методе валентных связей, в методе молекулярных орбиталей вводится понятие порядок связи.
Date: 2015-09-18; view: 909; Нарушение авторских прав