
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Метод валентных связей
|
|
Основные положения метода валентных связей. В. Гейтлер и Ф. Лондон в 1927 г. впервые нашли приближенное решение уравнения Шрёдингера для молекулы Н2. Позднее Л. Полинг, Дж. Слейтер и другие распространили этот метод на более сложные молекулы.
Отличие уравнения Шрёдингера для молекулы водорода от уравнения Шрёдингера для атома водорода состоит в том, что оно описывает поведение сразу двух электронов, которые находятся в поле двух протонов ядер (нарисовать рисунок), а не одного электрона в поле одного ядра, как это было у атома водорода. При этом поведение двух электронов описывается одной общей для них волновой функцией Ѱ. Потенциальная энергия Еп суммируется из шести слагаемых, четыре из которых характеризуют электростатическое взаимодействие противоположно заряженных частиц — взаимное притяжение, а два других — взаимное отталкивание частиц с одинаковым знаком заряда:
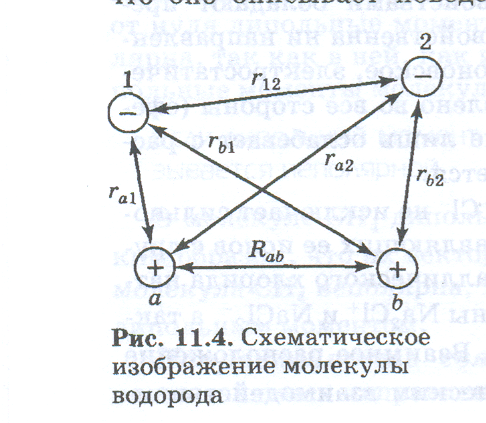
Как и для атомов, каждое из решений уравнения Шрёдингера должно состоять из волновой функции Ѱ и полной энергии Е и определяться набором квантовых чисел. Однако даже для такой простой системы, какой является молекула водорода, чисто математическое решение уравнения Шрёдингера невозможно. Поэтому решают уравнение Шрёдингера путем подбора такой волновой функции, при подстановке которой в уравнение получаются значения энергии связи Еса и равновесного межъядерного расстояния d0, точно соответствующие экспериментальным значениям этих величин. Величины Есв и d0 можно определить, например, из спектров молекулы Н2.
В. Гейтлер и Ф. Лондон предложили использовать в качестве приближенной общей волновой функции двух электронов молекулы Н2 линейную комбинацию (т. е. сумму или разность) произведений волновых функций двух атомов водорода:
Ѱ=Ѱa(1)Ѱb(2)±Ѱa(2)Ѱb(1)
Оба произведения включают в себя волновые функции двух независимых атомов водорода. Волновые функции Ѱa(1) и Ѱb(2), входящие в первое произведение, описывают ситуацию, когда электрон 1 принадлежит только ядру а, а электрон 2 — только ядру Ь. Волновые функции Ѱa(2) и Ѱb(1) получаются в результате так называемого электронного обмена, т. е. они означают, что электрон 2 полностью переходит к ядру а, а электрон 1 наоборот -- к ядру Ь. Каждое из произведений в правой части уравнения в отдельности не отражает реального состояния электронов в системе из двух сблизившихся атомов водорода. Так как различить электроны невозможно, в молекуле водорода вообще нельзя определить, какому же из двух ядер принадлежит каждый из электронов: оба электрона в равной мере принадлежат обоим ядрам. Это обобществление электронов в молекуле водорода и отражает волновая функция Гейтлера и Лондона.
Выражение для Ѱ равноценно двум волновым функциям: Ѱs, называемой симметричной, так как она не изменяется при замене электрона 1 на электрон 2, и ѰA, называемой антисимметричной, так как она при такой замене меняет свой знак:
ѰS= Ѱa(1)Ѱb(2)+Ѱa(2)Ѱb(1)
ѰA= Ѱa(1)Ѱb(2)-Ѱa(2)Ѱb(1)
Решение уравнения Шредингера для молекулы водорода с использованием волновой функции ѰS приводит к получению зависимости полной энергии системы из двух атомов водорода от расстояния между ними. Эта зависимость изображена на рис. (нарисовать рисунок) кривой 2, Минимум этой кривой означает уменьшение полной энергии системы при сближении атомов, т. е. образование химической связи. Рассчитанные с помощью волновой функции ѰS энергия связи и равновесное межъядерное расстояние довольно хорошо согласуютс я с экспериментальными данными.
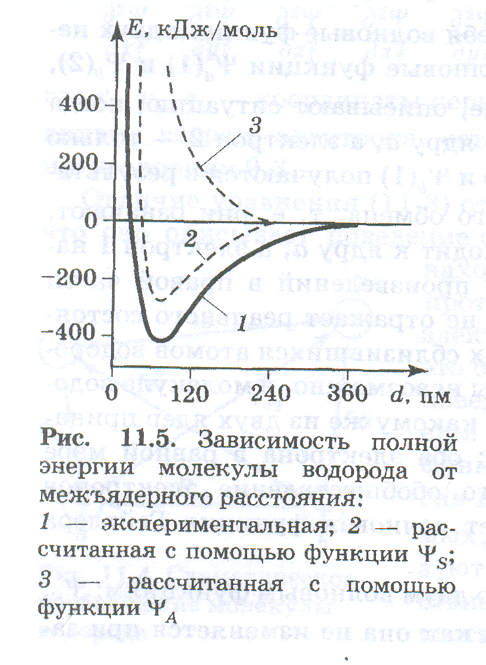
Волновая функция ѰS, общая для двух электронов, описывает электронную пару, В соответствии с принципом Паули эти электроны различаются значениями спиновых квантовых чисел, так как три других квантовых числа для одной и той же волновой функции совпадают. Отсюда можносделать вывод: образование химической связи за счет спа ривания электронов возможно только тогда, когда взаимодействующие электроны имеют антипараллельные спины.
Позже для расчета молекулы водорода были использованы волновые функции, состоящие из нескольких десятков членов, посредством которых удалось гораздо точнее описать электронное облако молекулы Н2. Одновременно было достигнуто весьма хорошее совпадение расчетных и экспериментальных значений энергии и длины связи в этой молекуле, но главными слагаемыми Ѱs в улучшенных расчетах неизменно остаются Ѱa(1)Ѱb(2)+Ѱa(2)Ѱb(1), предложенные Гейтлером и Лондоном и символизирующие электронную пару.
Зависимость полной энергии системы от межъядерного расстояния, полученная при использовании волновой функции ѰA, изображена на рис. кривой 3. На этой кривой отсутствует минимум. Это означает, что химическая связь образоваться не может, так как между атомами действуют только силы отталкивания. Волновая функция ѰA описывает систему из двух электронов с параллельными спинами. В соответствии с принципом Паули такая система не может быть устойчивой, электронные облака не перекрываются, а, наоборот, отталкиваются одно от другого.
Метод, использованный для расчета молекулы водорода, явился обоснованием метода валентных связей. Основные положения метода валентных связей можно сформулировать следующим образом.
• Одинарная ковалентная химическая связь между двумя атомами образуется обобществленной электронной парой. Электронная пара — это два электрона, имеющие общую волновую функцию и отличающиеся значениями спинового квантового числа.
• Связывающая электронная пара образуется при обобществлении, «перекрывании» орбиталей двух взаимодействующих атомов. Перекрываться могут только орбитали валентных электронных уровней. Перекрывание атомных орбиталей приводит к образованию связи только при совпадении знаков волновых функций для перекрывающихся частей орбиталей. Электронные остовы атомов участия в образовании связи не принимают.
Уменьшение энергии системы при образовании ковалентной химической связи вызвано действием сил электрической природы: остовы взаимодействующих атомов притягиваются к зоне повышенной электронной плотности, которая возникает в пространстве между ядрами при перекрывании электронных орбиталей. Чем больше перекрываются орбитали, тем прочнее связь и тем она короче.
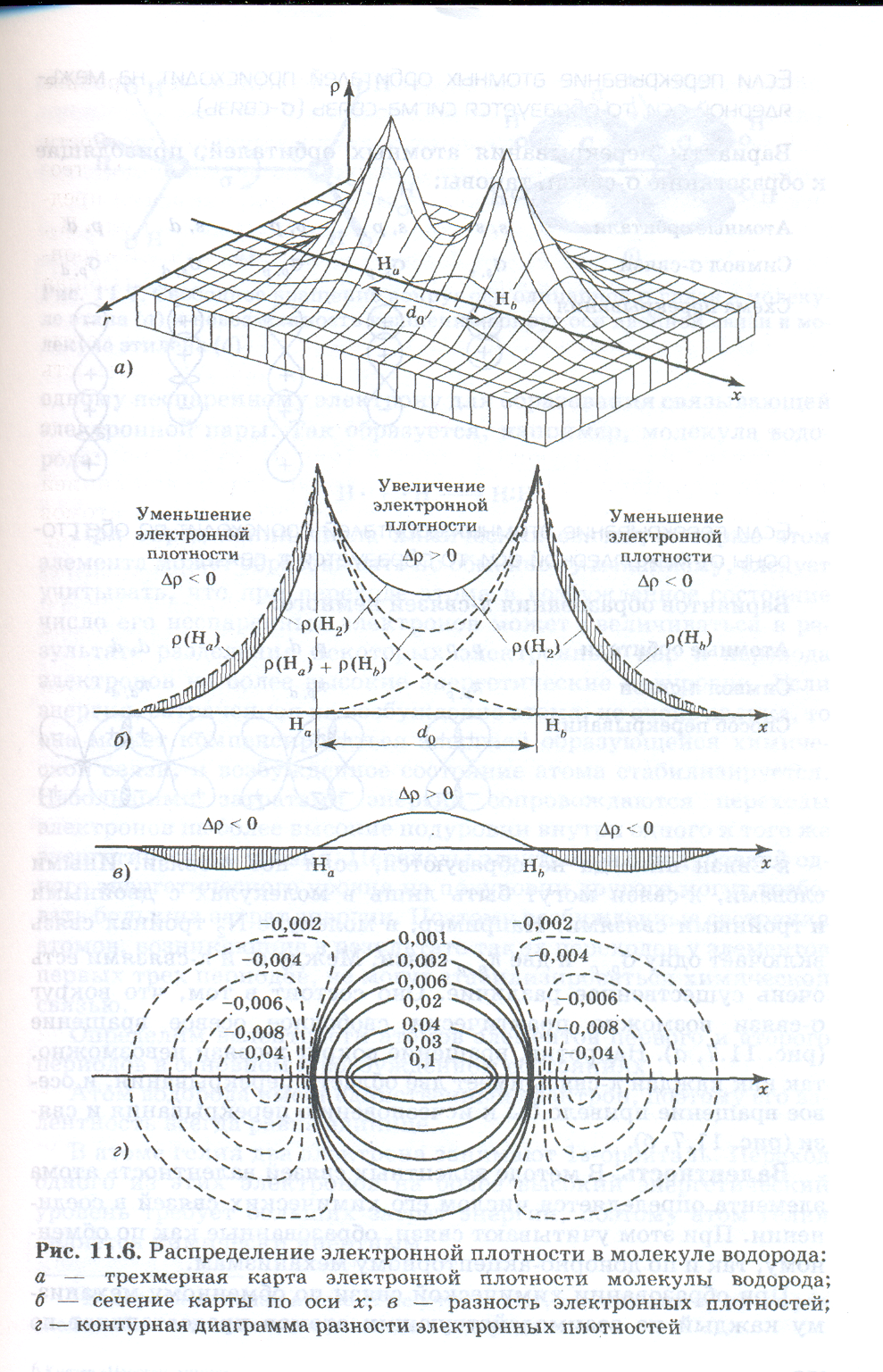
Молекула водорода. Распределение электронной плотности в молекуле водорода имеет принципиальное значение для теории ковалентной связи. На рис. (показать рисунок) четырьмя способами представлены результаты точных квантовых расчетов молекулы Н2. Рис. а — это трехмерная карта распределения электронной плотности ρ в координатах х, r, где х — ось, соединяющая ядра атомов водорода, r — расстояние от этой оси.
На рис. б показано вертикальное сечение этой карты по оси х. Сплошная линия изображает электронную плотность молекулы водорода ρ(Н2), а штриховые линии слева и справа от ядер атомов — электронные плотности ρ(Нa) и ρ(Нb) каждого из атомов, не образующих друг с другом связь, но сблизившихся на длину связи d0. Между ядрами штриховой линией показана сумма электронных плотностей несвязанных атомов
ρ(На) + ρ(Нb). В средней точке связи электронная плотность молекулы ρ(Н2) существенно больше, чем сумма плотностей несвязанных атомов. Это говорит о том, что при образовании химической связи возникает область повышенной электронной плотности между ядрами атомов,
На рис. в изображена разность электронных плотностей молекулы водорода и несвязанных атомов Δρ =ρ(Н2) - [ρ(На) + ρ(Нb)]. Эта кривая наглядно показывает, что между ядрами возникает избыток, сгущение электронной плотности, а с обеих сторон от ядер электронная плотность уменьшается.
На рис. г разность электронных плотностей передана в виде контурной диаграммы. Здесь линии соединяют точки с равными значениями Δρ. Сплошные линии соответствуют положительным значениям Δρ: они охватывают область сгущения электронного облака. Штриховые линии отвечают отрицательным значениям Δρ: они показывают, где электронная плотность в молекуле меньше, чем в несвязанных атомах.
Рис. наглядно показывает, что физическая причина электростатического стягивания ядер двух атомов водорода и образования ковалентной связи Н —Н заключается в убыли электронной плотности по обеим сторонам от ядер и ее увеличение в области между ядрами. Любая другая одинарная ковалентная связь имеет аналогичную картину распределения электронной плотности.
Кратные связи. Если два атома обобществляют две или три электронные пары, то образуется кратная (двойная или тройная) связь. При образовании кратных связей электронные облака могут перекрываться разными способами.
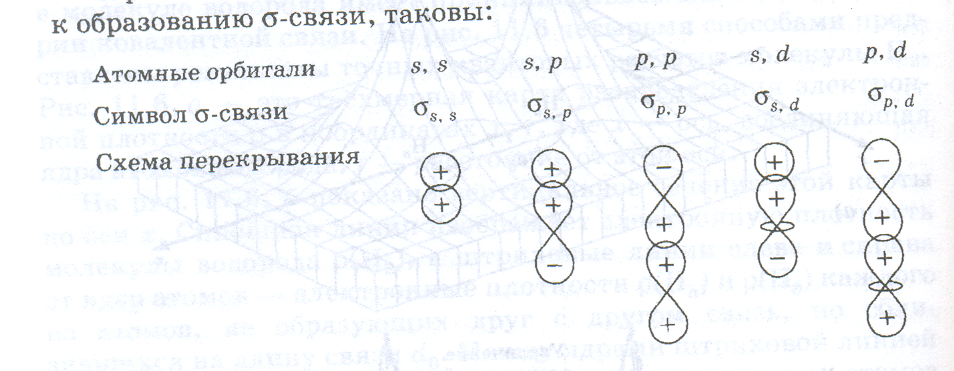
Если перекрытие атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь (σ-связь).
Варианты перекрывания атомных орбиталей, приводящих к образованию σ-связи, таковы:
Если перекрытие атомных орбиталей происходит по обе стороны от межъядерной оси, то образуется пи-связь (π-связь).
Вариантов образования π-связей немного:
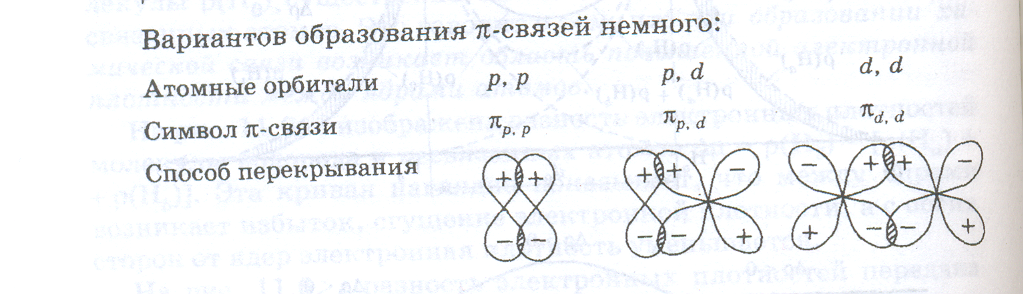
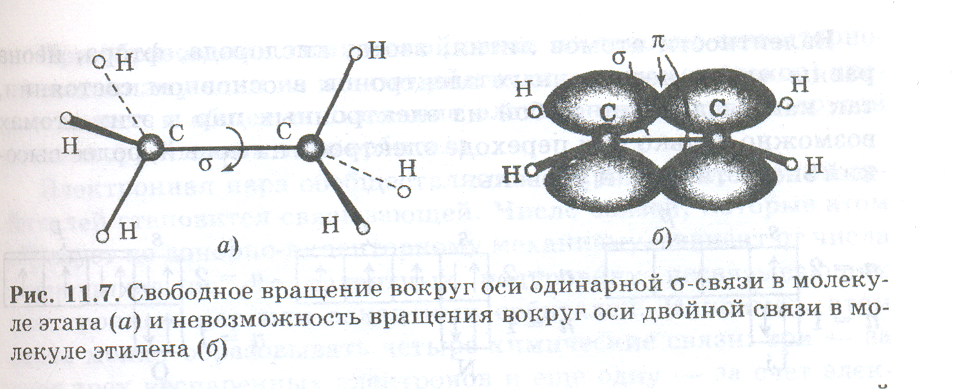
π-связи никогда не образуются, если нет σ-связи. Иными словами, π-связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну σpp - и две πpp -связи. Между σ- и π-связями есть очень существенное различие. Оно состоит в том, что вокруг σ -связи возможно практически свободное осевое вращение (нарисовать рисунок, а). Напротив, вращение вокруг π-связи невозможно, так как каждая π-связь имеет две области перекрывания, и осевое вращение привело бы к исчезновению перекрывания и связи (нарисовать рисунок, б).
Валентность. В методе валентных связей валентность атома элемента определяется числом его химических связей в соединении. При этом учитывают связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов предоставляет по
одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода:
Н · + · Н→Н: Н
При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбужденное состояние число его неспаренных электронов может увеличиваться в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбужденное состояние атома стабилизируется. Небольшими затратами энергии сопровождаются переходы электронов на более высокие подуровни внутри одного и того же энергетического уровня. Переходы электронов с подуровней одного энергетического уровня на подуровни другого могут требовать больших затрат энергии. Поэтому возбужденные состояния атомов, возникающие в результате таких переходов у элементов первых трех периодов, не могут стабилизироваться химической связью.
Определим валентности атомов элементов первого и второго периодов в основном и возбужденном состояниях.
Атом водорода имеет единственный электрон, поэтому его валентность всегда равна единице.
В атоме гелия два электрона занимают 1s-орбиталь. Переход одного из этих электронов на более высокий энергетический уровень требует больших затрат энергии, поэтому атом гелия является химически инертным.
Валентности атомов лития, азота, кислорода, фтора, неона равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электрона на новый, более высокий энергетический уровень:
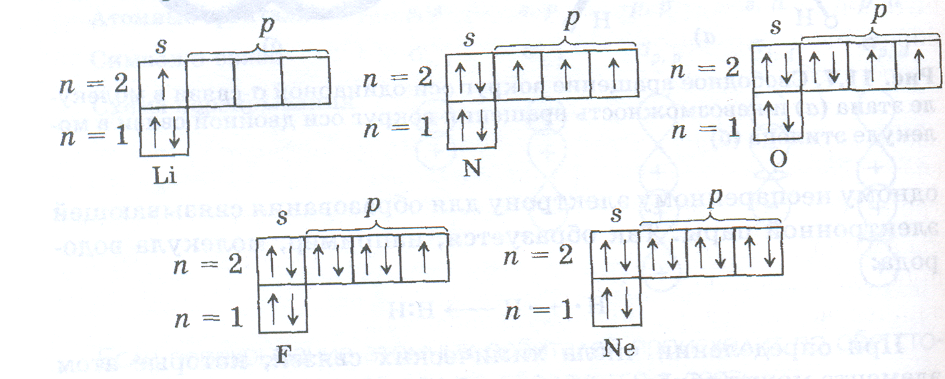
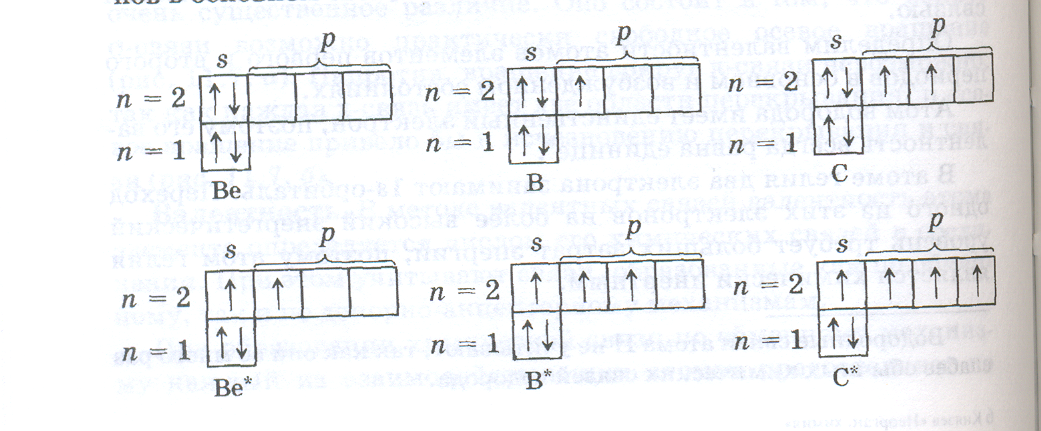
Из приведенных электронно-структурных формул видно, что валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0. В атомах бериллия, бора, углерода может происходить разделение электронных пар за счет перехода электронов с 2s-подуровня на 2р-подуровень, так как в атомах этих элементов на 2р-подуровне имеются вакантные орбитали. Такой переход на более высокий энергетический подуровень внутри данного энергетического уровня не требует больших затрат энергии, может быть скомпенсирован за счет образования химической связи и осуществляется в условиях обычных химических реакций. Поэтому валентности 2, 3 и 4, присущие атомам Ве, В, С, в возбужденном состоянии более характерны для этих элементов, чем валентности, определяемые числом неспаренных р-электронов в основном состоянии:
При образовании химической связи по донорно-акцепторному механизму один из взаимодействующих атомов (донор) предоставляет в общее пользование электронную пару, а другой (акцептор) — вакантную орбиталь.
Электронная пара обобществляется и при перекрывании орбиталей становится связывающей. Число связей, которые атом образует по донорно- акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три — за счет трех неспаренных электронов и еще одну — за счет электронной пары. Так образуется катион аммония NH4+ из молекулы аммиака, в которой донорный атом азота имеет несвязывающую электронную пару, и катиона водорода, предоставляющего в качестве акцептора свободную орбиталь:
H3N: + □H+→ [H3N:H]+
Атом бора образует молекулу фторида бора ВF3 за счет перекрывания электронных орбиталей, занятых в возбужденном состоянии неспаренными электронами, с электронными орбиталями фтора. При этом у атома бора сохраняется одна вакантная орбиталь, за счет которой по донорно-акцепторному механизму может образоваться четвертая химическая связь:
F- + □BF3+→ [ F BF3]-
Date: 2015-09-18; view: 1497; Нарушение авторских прав