
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типы и характеристики химической связи
|
|
Химическая связь — это взаимодействие атомов, приводящее к образованию молекул и кристаллов простых и сложных веществ и обеспечивающее их устойчивость.
Квантовая химия описывает химическую связь как результат электростатического взаимодействия между электронами валентных подуровней и положительно заряженными остовами атомов. Вещества, образующиеся благодаря возникновению химических связей, могут быть твердыми, жидкими и газообразными, они обладают широчайшим набором физических и химических свойств. Разнообразие строения и свойств химических соединений определяется особенностями свойств атомов и характером распределения электронной плотности между ними. Поэтому химические связи классифицируют по типу распределения электронной плотности.
Типы химических связей. Можно выделить следующие типы химических связей: ковалентная, ионная, полярная, координационная, металлическая, водородная.
Ковалентная связь образуется атомами одного и того же элемента, если каждый из них предоставляет для образования общих электронных пар неспаренные электроны своих валентных орбиталей. В результате обобществления двух электронов двух атомов возникает связывающая электронная пара. Электронная плотность связывающей пары имеет сгущение, располагающееся строго симметрично относительно связанных одинаковых атомов. Это сгущение стягивает положительно заряженные остовы атомов, энергия системы из двух атомов уменьшается, возникает связь. Чтобы отличить связывающую электронную пару, в графических формулах ее изображают двумя точками, расположенными между символами элементов, например Н: Н. Другие, несвязывающие, т. е. не участвующие в образовании связи, электронные пары атомов также изображают двумя точками, но их располагают не между символами элементов, а вблизи символа того атома, которому принадлежат несвязывающие электронные пары:
:Сl: Cl:
Ковалентная связь, осуществляемая одной электронной парой, называется одинарной.
В некоторых молекулах ковалентная химическая связь может образовываться не одной, а двумя или тремя электронными парами. В таких случаях говорят об образовании кратной химической связи ( двойной или тройной). Например, в молекуле азота образуется тройная связь:
Ионная связь образуется противоположно заряженными ионами, притягиваемыми друг к другу электростатическими силами.
Так, электростатическое взаимодействие в вакууме катиона Na+ и аниона Cl- приводит к образованию существующей в парах двухатомной молекулы Na+ Cl-. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия NaCl. И в молекуле Na+ Cl-, и в кристаллах NaCl почти не происходит обобществления электронов: атом натрия почти полностью отдает свой электрон атому хлора. Оба атома при этом приобретают устойчивые электронные конфигурации благородных газов,
Полярная связь является промежуточной между ковалентной и ионной. Сгущение электронной плотности между связанными полярной связью атомами смещено к более электроотрицательному из них. Другими словами, связывающая электронная пара в большей мере принадлежит более электроотрицательному атому. Полярные связи могут быть кратными.
Координационная связь в простейшем случае эквивалентна полярной связи, образуемой одной электронной парой. Ее отличие состоит лишь в механизме возникновения: она образуется, если один из атомов (донор) предоставляет для обобществления электронную пару, а второй (акцептор) — вакантную орбиталь, т. е. она является донорно-акцепторной.
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами.
Водородная связь является дополнительной связью атома водорода, уже входящего в состав соединения.
Характеристики химической связи. Важнейшие характеристики связи — это энергия, длина, степень ионности и направленность связи.
Энергия и длина связи. Любая молекула может образоваться из свободных атомов только при условии, что ее полная энергия меньше суммы полных энергий свободных атомов.
Сила, вызывающая образование химической связи, является равнодействующей сил притяжения и отталкивания. Силы притяжения начинают действовать между двумя произвольными атомами на расстояниях, в несколько раз превышающих их диаметры. Это силы взаимодействия валентных электронов одного из атомов с положительно заряженным остовом другого атома. Силы отталкивания проявляются на гораздо меньших расстояниях, чем силы притяжения, но они гораздо быстрее возрастают, так как обусловлены взаимодействием двух положительно заряженных атомных остовов.
Построим график зависимости полной энергии Е системы из двух атомов от расстояния между ядрами этих атомов d (нарисовать рисунок). Заначало координат примем ядро одного из атомов и представим, что ядро второго атома приближается к нему по оси абсцисс. Полную энергию этой системы примем равной нулю при больших расстояниях между атомами. Пусть силы притяжения становятся заметными, когда ядро второго атома оказывается в точке а. Стягивая атомы, силы притяжения совершают работу и уменьшают Е по мере сближения атомов на участке аb. Но, начиная с точки b, становятся заметными также и силы взаимного отталкивания электронных остовов, препятствующие слиянию атомов. Они постепенно возрастают при дальнейшем сближении атомов и на расстоянии d0 между ядрами уравновешивают силы притяжения. Межъядерное расстояние d0 называется длиной связи. В точке d0 кривая полной энергии Е имеет минимум. Разность энергий, отвечающая минимуму кривой Е - d, называется энергией связи Есв. При дальнейшем сближении атомов преобладающими становятся силы отталкивания, и полная энергия системы Е резко возрастает.
Связь образуется только при наличии минимума на кривой Е - d. Если
при любых расстояниях между двумя атомами силы отталкивания
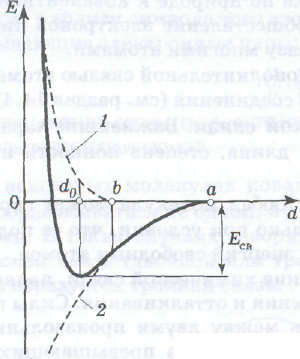

Рис. Зависимость полной энергии Е от межъядерного расстояния d между произвольными атомами:
1 — увеличение энергиисистемы в результате отталкивания;
2 — уменьшение энергии системы в результате притяжения
между ними преобладают над силами притяжения, то кривая Е - d не имеет минимума (рис. б) и связь не образуется.
Химическая связь отвечает наиболее энергетически выгодному состоянию системы из двух атомов. Она характеризуется экспериментально измеряемыми величинами - энергией связи Есв и длиной связи d0.
Длина химической связи — это расстояние между ядрами атомов, образуюших данную связь.
Энергия химической связи — это минимальная энергия системы из двух атомов.
Данное определение относится к энергии образования связи, которая всегда имеет отрицательные значения. Если же осуществить обратный процесс, т. е. разорвать химическую связь, и измерить затраченную на это энергию, то можно определить энергию разрыва связи, которая равна по абсолютной величине энергии образования связи, но в отличие от нее всегда имеет положительные значения. Например, энергия образования связи Н—Н равна -436 кДж/моль, а энергия разрыва этой связи составляет +436кДж/моль.
Энергия и длина связи определяются природой взаимодействующих атомов.
Степень ионности связи. В двухатомной молекуле, состоящей из атомов разных химических элементов, осуществляется полярная химическая связь. Связывающая электронная пара смещена к атому более электроотрицательного элемента. В результате он приобретает небольшой отрицательный заряд q-, а второй атом — равный ему по абсолютной величине положительный заряд q+. Такая молекула представляет собой электрический диполь и может быть охарактеризована электрическим дипольпым моментом.
Электрический дипольный момент равен произведению положительного заряда диполя на расстояние между зарядами и направлен от отрицательного полюса диполя к положительному:
μ=q×l,
где l — расстояние между зарядами.
Дипольный момент молекулы и расстояние между зарядами, которое равно длине связи, можно определить экспериментально, и на этой основе вычислить значения эффективных зарядов атомов q.
В молекулах с чисто ковалентной связью Н2, N2, О2 и т. п. эффективные заряды атомов равны нулю. В молекулах, состоящих из атомов разных химических элементов, эффективные заряды не равны нулю, но не равны и расчетным зарядам, которые приписываются атомам, если химические связи рассматриваются как чисто ионные. Например, в молекуле НF, если ее рассматривать как ионное соединение, заряд атома фтора должен быть равен -1, а заряд атома водорода + 1. Рассчитанный же на основе экспериментальных данных эффективный заряд атома фтора равен -0,42, а заряд атома водорода +0,42. Такие значения эффективных зарядов атомов свидетельствуют о том, что в молекуле НF электронная плотность смещена в сторону атома F, но полной передачи электрона от атома Н к атому F нет. Другими словами, химическая связь в молекуле фтороводорода является промежуточной по характеру распределения электронной плотности между чисто ионной и чисто ковалентной, т. е. полярной связью.
Для оценки вклада ионного и ковалентного механизмов в образование полярной связи можно воспользоваться значением эффективного заряда атома.
Степень ионности связи i равна отношению эффективного qэф и расчетного qрасч зарядов атома:
i = qэф/ qрасч×100%
Степень ионности связи равна нулю в состоящих из одинаковых атомов молекулах с чисто ковалентными связями, например, в Н2, Cl2, О2, N2, Р4, S8, но нет молекул, в которых она равна 100%. Молекулы с чисто ионными связями не существуют.
Близкими к 100% степенями ионности обладают связи между самыми электроположительными и самыми электроотрицательными элементами. Это связи в молекулах галогенидов щелочных металлов, аналогичных существующей в парах(газовая фаза) молекуле LiF. Степень ионности этой связи равна 89%.
Большинство молекулярных соединений, например НF, Н20, NН3, СН4, существующих при обычных температурах, имеют полярные связи. Наибольшей ионностью среди таких молекул обладает НF. Как показано в таблице, степень ионности связи Н—F составляет 42%.
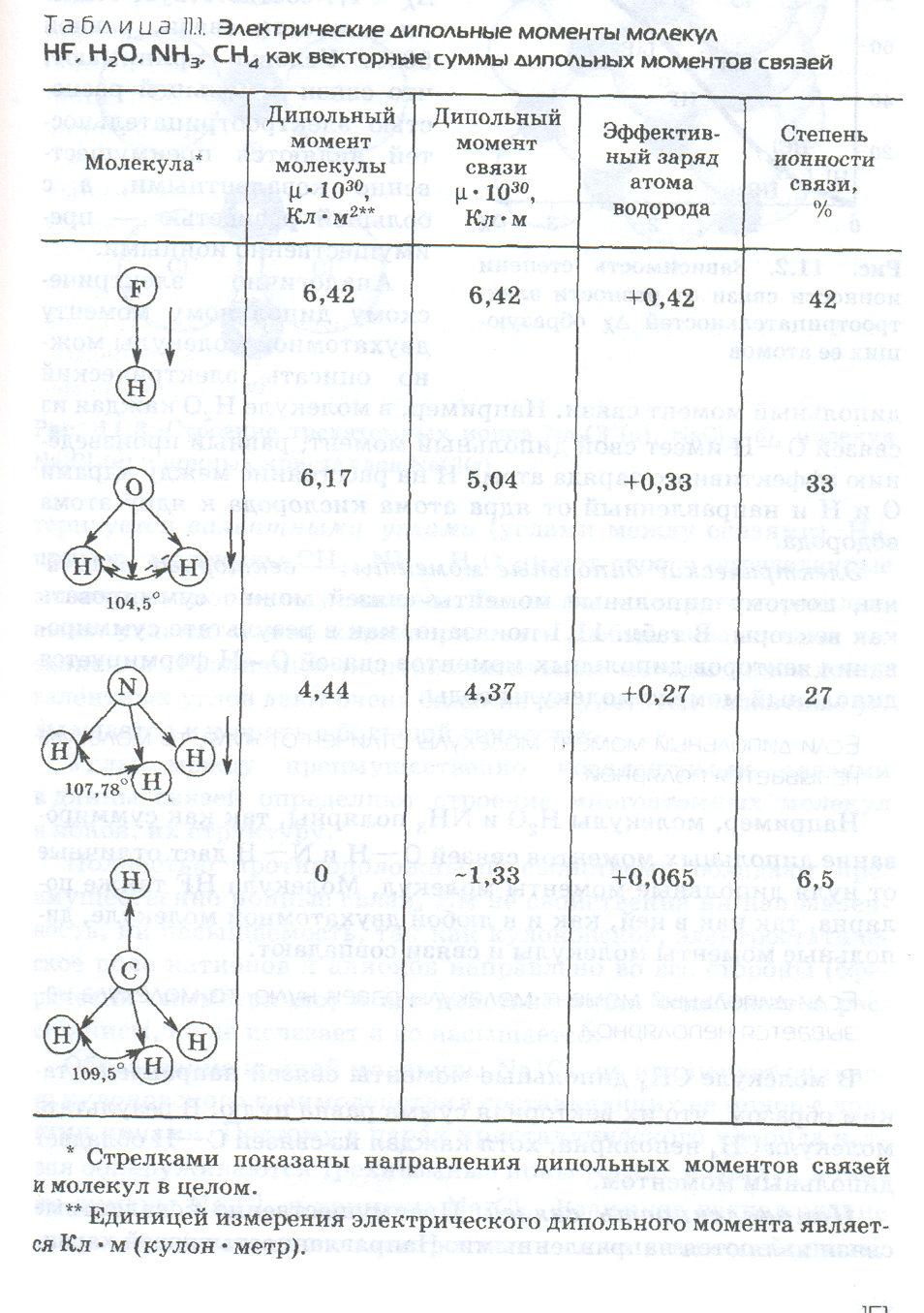 Аналогично электрическому дипольному моменту двухатомной молекулы можно описать электрический дипольный момент связи. Например, в молекуле Н2О каждая из связей О—Н имеет свой дипольный момент, равный произведению эффективного заряда атома Н на расстояние между ядрами О и Н и направленный от ядра атома кислорода к ядру атома водорода.
Аналогично электрическому дипольному моменту двухатомной молекулы можно описать электрический дипольный момент связи. Например, в молекуле Н2О каждая из связей О—Н имеет свой дипольный момент, равный произведению эффективного заряда атома Н на расстояние между ядрами О и Н и направленный от ядра атома кислорода к ядру атома водорода.
Электрические диполъные моменты — векторные величины, поэтому дипольные моменты связей можно суммировать как векторы. В таблице показано, как в результате суммирования векторов дипольных моментов связей О—Н формируется дипольный момент молекулы воды.
Если дипольный момент молекулы отличен от нуля, то молекула называется полярной.
Например, молекулы Н2О и NН3 полярны, так как суммирование дипольных моментов связей О—Н и N — Н дает отличные от нуля дипольные моменты молекул. Молекула НF также полярна, так как в ней, как и в любой двухатомной молекуле, дипольные моменты молекулы и связи совпадают.
Если дипольный момент молекулы равен нулю, то молекула называется неполярной.
В молекуле СН4 дипольные моменты связей направлены таким образом, что их векторная сумма равна нулю. В результате молекула СН4 неполярна, хотя каждая из связей С—Н обладает дипольным моментом.
Направленность связей. Преимущественно ковалентные связи являются направленными. Направленность связей характеризуется валентными углами (углами между связями). Например, молекулы СН4, NН3, Н2О имеют строго определенные значения углов между связями. Точно так же строго определенными углами можно характеризовать любые ковалентные соединения. Различные экспериментальные методы нахождения валентных углов дают очень близкие результаты, валентные углы удается измерять с большой точностью.
Углы между преимущественно ковалентными связями и длины связей определяют строение многоатомных молекул и ионов, их структуру.
Полностью противоположными свойствами обладают преимущественно ионные связи. Им не свойственна ни направленность, ни насыщаемость, так как кулоновское, электростатическое поле катионов и анионов направлено во все стороны (сферически симметрично) и его действие лишь ослабевает с расстоянием, но не исчезает и не насыщается.
Образование ионной молекулы Nа+С1- не исключает сильного кулоновского взаимодействия составляющих ее ионов с другими ионами. Поэтому в парах кристаллического хлорида натрия обнаруживаются трехатомные ионы Nа2Сl+ и NаСl2-, а также димеры Na2Сl2 и тримеры Nа3Сl3. Взаимное расположение ионов определяется их электростатическим взаимодействием.
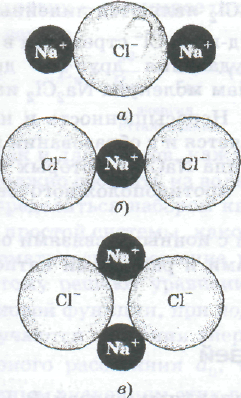
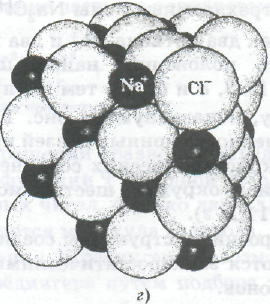
Строение трехатомных ионов Na2Cl- (а), NаСl2- (б), молекул Nа2Сl2(в) и ионных кристаллов NаСl(г)
Так, трехатомные ионы Nа2Сl+ и NаСl2- являются линейными,
так как два катиона Nа+ и два хлорид-иона Сl- стремятся в них занять положения наибольшего удаления друг от друга (рис. а и б). По тем же причинам молекула Nа2Сl2 имеет форму, показанную на рис. в. Ненасыщенность и ненаправленность ионных связей проявляется и в образовании ионных кристаллических соединений типа NаС1, в которых каждый ион окружен шестью ионами противоположного знака (рис. г).
Строение и структуры соединений с ионными связями определяются электростатическими силами и размерами катионов и анионов.
Date: 2015-09-18; view: 1704; Нарушение авторских прав