
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Стохастическая динамика и электронно-конформационные взаимодействия в белках
|
|
Отдельно следует рассмотреть целый класс стохастических моделей динамики белков, и, в частности, ионных каналов, которые основаны на принципах электронных и конформационных взаимодействий в белках [41-46].
Белковые комплексы рассматривается как вязкоупругие объекты [46], обладающие большим количеством степеней свободы.
Перераспределение химических связей в ходе взаимодействия активных центров белковых соединений с ионами изменяет распределение электронной плотности в реагирующих молекулах, изменяя тем самым баланс сил внутри белка, что приводит к тому, что равновесная конформация белка до и после реакции различны. Это явление называется электронно-конформационным взаимодействием, а соответствующее изменение структуры – электронно-конформационным переходом [45, 47]. Этот переход можно также рассматривать и как конформационную релаксацию под действием нескомпенсированных сил, возникающих после акта перераспределения электронной плотности или иных изменений в активном центре белка. Присоединение очень небольшого по размерам иона к активному центру ионного канала вызывает существенные изменения конформации белка – поворот субъединиц на расстояние порядка 10 А. Этот пример показывает, насколько тонким является баланс сил, стабилизирующих конформацию белковой структуры.
Ярким примером являются непрерывные модели, к примеру, модель процессов открытия Са2+-активируемых K+-каналов [45]. При разработке данной математической модели авторы основывались на ряде важнейших фактов, выявленных экспериментально и характеризующих кинетику активности ионных каналов, таких как:
1) распределение кинетических параметров может иметь не экспоненциальное, а степенное распределение.
2) распределения имеют фрактальную структуру (самоподобны в различных временных масштабах [47, 48]);
3) существует скоррелированность событий ("память") в активности канала [48].
4) кинетика переходов канала между различными состояниями определяется не только случайными, но и детерминированными силами [48].
В модели [41] конформационное состояние канала и, соответственно, его проводимость определялись с помощью введения угла отклонения подвижных трансмембранных сегментов канала от центральной оси поры (рис. 1.17). Предполагалось, что канал при отсутствии внешних воздействий может находиться в двух устойчивых состояниях (открытое и закрытое). Переходы между состояниями осуществляются благодаря воздействию тепловых флуктуаций на подвижные части сегментов. Потенциальная энергия воротного механизма (структуры) описывается функцией с двумя локальными минимумами, соответствующими открытому и закрытому состояниям канала (рис. 1.17г).
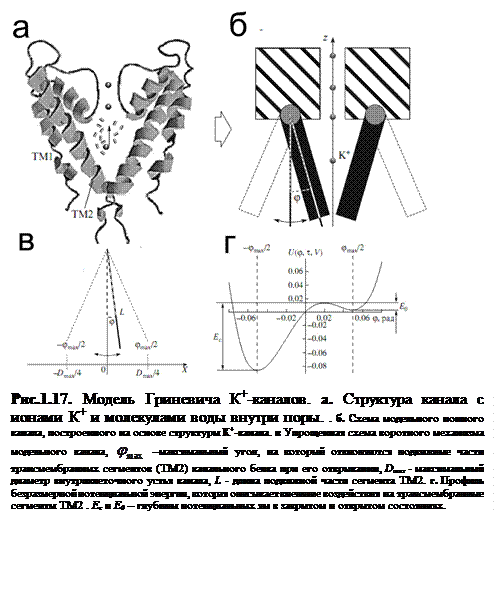
Таким образом, существует альтернатива теориям, основанных на марковских процессах, описывающих процессы открытия/закрытия ионных каналов. Вышеописанные модели позволяют более детально описать динамику биомолекул и предполагают использование энергетического подхода к описанию конформационных изменений различных биофизических объектов.
1.5 Кооперативная динамика группы RyR-каналов. Са2+-высвобождающая единица
Начальное возрастание концентрации внутриклеточного кальция в ответ на электрическое возбуждение происходит благодаря поступлению ионов извне через L-каналы, однако такого повышения концентрации недостаточно для сокращения клетки [1, 11, 50, 51]. Внешний приток Са2+ активирует группы RyR-каналов, являясь стимулом для последующего высвобождения Са2+ из СР и повышения уровня Са2+ в цитозоле на порядок величины. Данный триггерный процесс носит название «кальцием вызванное высвобождение кальция» (КВВК) [1]. После высвобождения Са2+ из СР в диадное пространство и дальнейшей его диффузии в цитозоль увеличивается концентрация Са2+ вблизи миофибрилл, что приводит к сокращению саркомера. Относительная однородность повышения концентрации Са2+ в клетке обеспечивается особым устройством СР с небольшим расстоянием (не более 1 мкм) от любой точки клетки до ближайшей высвобождающей единицы [10].
Являясь одним из ключевых процессов электромеханического сопряжения, процесс КВВК требует тщательного экспериментального анализа и соответствующего математического моделирования.
1.6 Локальные высвобождения Са2+ в кардиомиоцитах
Важным этапом в исследовании динамики Са2+ в кардиомиоцитах являются эксперименты по изучению локальных высвобождений Са2+ в клетках при помощи конфокальной микроскопии и Са2+-чувствительного индикатора fluo-3, fluo-4, или rhod-2 [51]. Резкое локальное повышение концентрации цитозольного Са2+ в покоящейся клетке, называется Са2+ спарком [52-54]. Спарки в клетке наблюдаются с частотой около 100 в секунду [53].
На рисунке 1.18 приводятся результаты продольного сканирования сердечной клетки крысы, которая загружена индикатором fluo-3. Каждый Са2+ спарк является по форме почти сферическим с приблизительным диаметром 2 мкм. Как видно из рисунка 1.18в, значение концентрации покоя Са2+ около 100 нM, а значение локальных пиков концентрации от 200 до 300 нM.
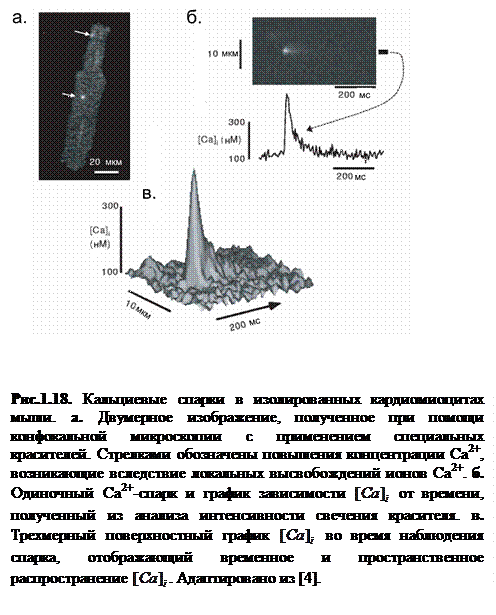
Поскольку Са2+ спарки формируются кластерами RyR-каналов, они преимущественно наблюдаются вдоль саркомера и T-тубулы. На рисунке 1.18б представлено усредненное изображение спарков перпендикулярно Т-тубулы.
1.7 Модели «общего пула»
Одной из самых распространенных теорий для описания процесса КВВК на протяжении долгого времени являлась так называемая «теория общего пула» [55-57]. Она основана на усреднении концентрации Са2+ в сарколемме и в субклеточных пространствах. В рамках этой модели огромное количество Са2+-высвобождающих единиц описывались одной обобщенной модельной высвобождающей единицей. При этом поток Са2+ через L-каналы объединен в общий стимулирующий поток, а поток высвобождающегося Са2+ – в общий поток высвобождения. Оба этих потока направлены в один обобщенный отдел клетки, называемый субпространством (объединенное диадное пространство), причём процесс высвобождения зависит от концентрации Са2+ в субпространстве. Следовательно, однажды запущенное высвобождение Са2+ из СР должно повышать концентрацию Са2+ в субпространстве по принципу "всё или ничего". Согласно этой модели количество высвободившегося Са2+ не зависит от величины стимулирующего мембранного тока, что противоречит экспериментальным данным [58].
С помощью этого обобщения в целом ряде других математических моделей, использующих теорию общего пула, исследователи пытались описать изменение концентрации Са2+ внутри клетки в течение сократительного цикла – кальциевый переход. Эти модели опирались на кинетические характеристики процессов накопления Са2+ во внутриклеточных структурах и взаимодействие с буферами [59, 60].
Объединение модели общего пула с интегративными моделями кардиомиоцитов позволило с хорошей степенью точности предсказать динамические процессы активности клетки [61].
Однако модель общего пула имеет ряд недостатков. В частности, она не способна описать следующие экспериментальные факты [29-33 ]:
· явление нелинейного усиления отклика высвобождающих структур СР на увеличивающийся приток Са2+ извне – явление градуальности.
· эффект быстрого завершения активного высвобождения после исчезновения стимула – termination.
· эффект адаптации высвобождения к повторной стимуляции.
Как уже отмечалось, запуск процесса КВВК в сердечной клетке стимулируется незначительным повышением концентрации Са2+ в цитозоле вследствие поступления внеклеточного Са2+ через L-каналы [1].
Явление градуальности отклика обнаружено экспериментально и заключается в том, что при увеличении количества Са2+, поступающего извне, происходит возрастание количества высвободившегося Са2+. Кроме того, отклик высвобождающей системы сильно зависит от скорости повышения стимулирующего Са2+ тока [1]. Этот феномен невозможно описать в рамках модели общего пула.
Весте с тем, целый ряд экспериментов указывает на то, что в процессе высвобождения СР после его завершения концентрация Са2+ в СР не падает до нулевого уровня [52]. В модели же общего пула высвобождение Са2+ завершается при полном опустошении СР по принципу «все или ничего».
Опираясь на данные расхождения, можно сделать вывод о неспособности модели общего пула с хорошей точностью описать динамические процессы ионов Са2+ в кардиомиоците.
Date: 2015-08-24; view: 839; Нарушение авторских прав