
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства солей. Соли являются твердыми кристаллическими веществами
|
|
Соли являются твердыми кристаллическими веществами. По растворимости их можно разделить на растворимые, малорастворимые и практически нерастворимые.
| Кислоты | Растворимость солей |
| HNO3, CH3COOH | Растворимы все соли |
| HCl | Растворимы все соли, кроме AgCl, Hg2Cl2, CuCl,PbCl2. |
| H2SO4 | Растворимы все соли, кроме BaSO4, SrSO4, PbSO4; очень мало растворимы CaSO4, Ag2SO4 |
| H2CO3 H3PO4 H2S | Из средних солей растворимы только соли натрия, калия и аммония |
| Металлы: натрий, калий | Растворимы почти все соли |
Растворимость солей, а также оснований приведена в таблице растворимости.
Химические свойства солей обусловлены их отношением к металлам, щелочам, кислотам, солям.
1). В ряду напряжений каждый предыдущий металл вытесняет последующие из растворов их солей:
Zn + CuSO4 = > Cu + ZnSO4
Zn0 + Cu2+ => Cu0 + Zn2+.
2). В водных растворах соли могут взаимодействовать со щелочами, образуя новую соль и новое основание при условии, если один из продуктов реакции будет нерастворим или образуется слабый электролит:
CuSO4 + 2NaOH => Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- => Cu(OH)2 ↓
Na2SO4 + Ba(OH)2 => BaSO4 ↓ + 2 NaOH
SO4 2-+ Ba2+ => BaSO4 ↓
NaHCO3 + NaOH => Na2CO3+H2O
HCO3- + OH- => CO32- + H2O
3). Соли, образованные летучими или слабыми кислотами типа HCl, H2S, H3PO4, взаимодействуют с нелетучими кислотами, например H2SO4, с выделением летучей или слабой кислоты или образованием новой нерастворимой соли:
CuCl2 + H2S => CuS ↓+ 2 HCl ↑
Cu2+ + H2S => CuS ↓ + 2 HCl ↑
CaS + H2SO4 => CaSO4 + H2S ↑
NiOHCl + HCl => NiCl2 + H2O
NiOH+ + H+ => Ni2+ + H2O
4). Соли взаимодействуют между собой с образованием новых солей:
СaCl2 + 2 AgNO3 => 2 AgCl ↓ + Ca(NO3)2
Cl- + Ag+ = > AgCl ↓
Реакции протекают до конца лишь в том случае, если один из образующихся продуктов уходит из сферы реакции, то есть выпадает в виде осадка, уходит в виде газа или образуется малодиссоциированное соединение. Если же продукты реакции, так же как и исходные вещества, хорошо растворимы в воде, то такие реакции будут обратимы.
5). Некоторые соли подвергаются разложению при высокой температуреCaCO3 = > CaO + CO2↑
Характерной особенностью солей является то, что они представляют собой конечный продукт генетического ряда рассмотренных классов неорганических соединений:



 Элемент оксид основание (кислота) соль.
Элемент оксид основание (кислота) соль.
Этот ряд иллюстрирует возможность образования веществ одного класса из веществ другого класса. Соль, как конечный продукт, объединяет, таким образом, генетические ряды классов соединений, начинающиеся как с металлов, так и с неметаллов по следующей схеме:

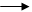 Неметалл Соль бескислородной Металл
Неметалл Соль бескислородной Металл
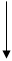
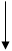 кислоты
кислоты
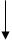 |

 Кислотный Соль Основной
Кислотный Соль Основной
 оксид оксид
оксид оксид
 |  |

 Кислота Соль Основание
Кислота Соль Основание
С помощью этой схемы можно представить 10 различных способов
получения солей.
Date: 2015-05-22; view: 870; Нарушение авторских прав