
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решений
|
|
Вопросы для самоподготовки
1. Предмет химической термодинамики. Термодинамические системы. Фаза.
2. Внутренняя энергия. Первый закон термодинамики.
3. Тепловые эффекты при постоянном объёме и при постоянном давлении. Энтальпия.
4. Термохимические уравнения. Закон Гесса.
5. Энтропия. Уравнение Больцмана. Второй закон термодинамики.
6. Изменение энтропии в различных процессах. Третий закон термодинамики.
7. Свободная энергия Гиббса. Направление химического процесса.
Задания
1. Вычислите теплоту сгорания этилена, если известно, что теплота его образования равна 52,3 кДж/моль. Рассчитайте тепловой эффект реакции сгорания 10 л этилена, если объем измерен при 27 °С и 98,64 кПа.
2. Вычислить DН° реакции обжига пирита FeS2, приняв DН°f(FeS2) = -177 кДж/моль, DН°f(SО2) = -296,9 кДж/моль, DН°f(Fe2О3) = -821,3 кДж/моль.
3. Рассчитайте DG0 реакций и установите в каком направлении они могут протекать самопроизвольно:
а) NiO(к) + Pb(к) = Ni(к) + PbO(к);
б) СuO(к) + Pb(к) = Cu(к) + PbO(к);
в) 3Fe3O4(к) + 8Al(к) = 9Fe(к) + 4Al2O3(к)
4. Вычислить DG0 реакции:
CaCO3(к) = CaO(к) + CO2(г)
при 25, 500 и 1500°С. Зависимостью DS0 и DН0 от температуры пренебречь.
5. Не проводя вычислений, установите знак DS0 следующих процессов:
а) 2NH3(г) = N2(г) + 3H2(г); б) CO2(к) = CO2(г);
в) 2H2S(г) + 3O2(г) = 2H2О(ж) + 2SO2(г)
Примеры решений
Пример № 1. Рассчитайте тепловой эффект реакции термического разложения карбоната кальция:
CaCO3(к) = CaO(к) + CO2(г);
Решение. Применение второго следствия из закона Гесса позволяет рассчитать тепловой эффект реакции, если известны стандартные энтальпии образования реагентов и продуктов реакции (справочные данные).
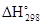 =
= 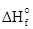 (CaO) +
(CaO) + 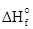 (CO2) -
(CO2) - 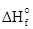 (CaCO3);
(CaCO3);
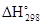 = -635,5 + (-393,5) - (-1206,9) = 177,9 (кДж).
= -635,5 + (-393,5) - (-1206,9) = 177,9 (кДж).
Ответ: -177,9 кДж.
Пример № 2. Рассчитайте изменение энтропии, отвечающее синтезу карбоната и силиката кальция из соответствующих оксидов:
Решение. 1) СаО(к) + СО2(г) = СаСО3(к)
Поскольку энтропия является функцией состояния, изменение энтропии при протекании химической реакции может быть вычислено по уравнению:
ΔSo = 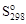 (СаСО3) - [
(СаСО3) - [ 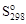 (CаО) +
(CаО) + 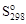 (СО2)] = 91,7 - (38,1 + 213,7) = -160,1 (Дж/моль × К).
(СО2)] = 91,7 - (38,1 + 213,7) = -160,1 (Дж/моль × К).
2) СаО(к) + SiO2(к) = СаSiO3(к)
ΔSo = 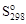 (CaSiO3) - [
(CaSiO3) - [ 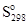 (CaO) +
(CaO) + 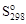 (SiO2)] = 81,0 - (38,1 + 4,2) = 1,7 (Дж/моль×К)
(SiO2)] = 81,0 - (38,1 + 4,2) = 1,7 (Дж/моль×К)
Ответ: реакция образования карбоната кальция, при которой происходит связывание газообразного вещества (СО2), сопровождается существенным уменьшением энтропии системы, а при синтезе силиката кальция из кристаллических оксидов энтропия почти не изменяется.
Пример № 3. Рассчитать 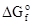 для Fe3O4, если известна энтальпия образования этого соединения ΔНоf(Fe3O4) = -1117,13 кДж/моль и энтропии
для Fe3O4, если известна энтальпия образования этого соединения ΔНоf(Fe3O4) = -1117,13 кДж/моль и энтропии 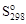 железа, кислорода и Fe3O4, равные 27,15; 205,04 и 146,19 Дж/моль.К.
железа, кислорода и Fe3O4, равные 27,15; 205,04 и 146,19 Дж/моль.К.
Решение.
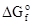 (Fe3O4) =
(Fe3O4) = 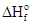 (Fe3O4) - Т
(Fe3O4) - Т 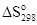 ,
,
где Δ 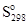 - изменение энтропии при протекании реакции: 3Fe + 2O2 = Fe3O4
- изменение энтропии при протекании реакции: 3Fe + 2O2 = Fe3O4
Изменение энтропии рассчитывается по следующему уравнению:
Δ 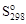 =
= 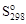 (Fe3O4) - [3
(Fe3O4) - [3 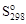 (Fe) + 2
(Fe) + 2 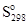 (O2)];
(O2)];
Δ 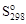 = 146,19 - (3.27,15 + 2.205,04) = 345,3(Дж/моль . К).
= 146,19 - (3.27,15 + 2.205,04) = 345,3(Дж/моль . К).
Тогда
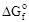 (Fe3O4) = -1117,13 - 298(-0,34534) = -1014,2 (кДж/моль).
(Fe3O4) = -1117,13 - 298(-0,34534) = -1014,2 (кДж/моль).
Ответ: -1014,2 кДж/моль, реакция принципиально возможна при стандартных условиях.
Пример № 4. Оцените принципиальную возможность получения озона при взаимодействии азотной кислоты с кислородом (условия стандартные) по уравнению:
4HNO3(ж) + 5O2(г) = 4O3(г) + 4NO2(г) + 2H2O(ж)
Решение. Поскольку G является функцией состояния, то для реакции изменение энергии Гиббса можно определить по уравнению:
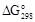 = [4
= [4 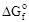 (O3) + 4
(O3) + 4 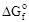 (NO2) + 2
(NO2) + 2 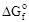 (H2O)] - [4
(H2O)] - [4 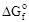 (HNO3) + 5
(HNO3) + 5 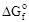 (O2)];
(O2)];
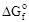 = 4·162,78 + 4·52,29 - [4(-79,90) + 5·0] = 1179,82 (кДж)
= 4·162,78 + 4·52,29 - [4(-79,90) + 5·0] = 1179,82 (кДж)
Ответ: Самопроизвольное протекание реакции при стандартных условиях принципиально невозможно. В то же время диоксид азота может быть окислен озоном до азотной кислоты, так как для обратной реакции значение ΔG отрицательно.
Пример № 7. Вычислить изменение энтропии при стандартных условиях для реакции
Н2S(г) + Сl2(г) = 2НСl(г) + S(к),
если энтропии Н2S(г), Сl2(г), НСl(г) и S(к) равны соответственно 205,6; 223,0; 186,7 и 31,8 Дж/моль . К.
Решение. Поскольку энтропия является функцией состояния, то
Δ 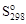 =
= 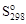 (S) + 2
(S) + 2 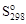 (НСl) -
(НСl) - 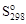 (Н2S) -
(Н2S) - 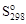 (Сl2) = 31,8 +2.186,7 - 223 - 205,6 = -23,4 (Дж/моль . К).
(Сl2) = 31,8 +2.186,7 - 223 - 205,6 = -23,4 (Дж/моль . К).
Ответ: -23,4 Дж/моль . К.
Date: 2015-05-09; view: 3845; Нарушение авторских прав