
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Внутренняя энергия. Термодинамика (или общая теория теплоты) предлагает альтернативный, по отношению к методам статистической физики
|
|
Термодинамика (или общая теория теплоты) предлагает альтернативный, по отношению к методам статистической физики, подход к объяснению свойств макроскопических систем. Термодинамика начала складываться раньше статистической физики, в период, когда еще не существовало достоверных представлений о микроструктуре вещества. По этой причине в термодинамике используются понятия и величины, характеризующие систему в целом (объем, температура, давление и т.д.). В основе термодинамики лежат два закона (или начала), представляющие собой постулаты, являющиеся обобщением большого числа опытных фактов. Термодинамика и статистическая молекулярная физика изучают одни и те же макроскопические объекты, дополняя друг друга. Поэтому при изложении основ термодинамики мы будем использовать некоторые результаты, полученные в рамках молекулярной физики (например, уравнение Менделеева-Клапейрона и теорему Больцмана).
Одним из основных понятий, которыми оперирует термодинамика, является внутренняя энергия. Внутренней энергией U макроскопического тела называется величина, равная сумме кинетической энергии хаотического теплового движения его молекул, потенциальной энергии взаимодействия молекул между собой и энергии движения и взаимодействия атомов в пределах молекул. Внутренняя энергия является однозначной функцией состояния системы. Ее значение в каком-либо состоянии зависит только от макроскопических параметров системы, характеризующих данное состояние, и не зависит от того, каким именно образом система перешла в это состояние. Иными словами, изменение внутренней энергии 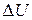 при переходе системы из состояния 1 в состояние 2 не зависит от вида перехода, а определяется только величиной U в этих состояниях:
при переходе системы из состояния 1 в состояние 2 не зависит от вида перехода, а определяется только величиной U в этих состояниях: 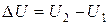 . Отсюда следует, что, если в результате какого-либо процесса система возвращается в исходное состояние, то изменение ее внутренней энергии равно нулю.
. Отсюда следует, что, если в результате какого-либо процесса система возвращается в исходное состояние, то изменение ее внутренней энергии равно нулю.
Л. Больцман, используя методы статистической физики, доказал теорему, согласно которой на одну поступательную и на одну вращательную степень свободы молекулы приходится в среднем kT /2 кинетической энергии, на одну колебательную степень свободы приходится в среднем энергия, равная kT. Иначе говоря, средняя кинетическая энергия молекулы 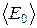 может быть найдена как
может быть найдена как
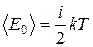 , (3.1)
, (3.1)
где число степеней свободы молекулы i равно сумме числа поступательных iп, вращательных iв и удвоенного числа колебательных iк степеней свободы молекулы:
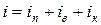 . (3.2)
. (3.2)
Энергия молекулы, связанная с поступательными и вращательными степенями свободы – это кинетическая энергия хаотического теплового движения молекулы как единого целого. Энергия, связанная с колебательными степенями свободы, представляет собой суммарную кинетическую и потенциальную энергию колебания атомов в пределах молекулы.
Эксперименты показывают, что колебательное движение атомов в молекулах возбуждается только при достаточно высоких температурах (свыше 1000 К), поэтому в дальнейшем, кроме особо оговоренных случаев, мы будем им пренебрегать и полагать  . Иными словами, мы будем считать многоатомные молекулы чем-то вроде «микроскопических абсолютно твердых тел», сохраняющих свои размеры и форму неизменными.
. Иными словами, мы будем считать многоатомные молекулы чем-то вроде «микроскопических абсолютно твердых тел», сохраняющих свои размеры и форму неизменными.
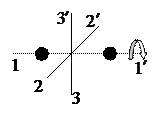
Рис. 3.1
Число поступательных и вращательных степеней свободы молекул определяется числом входящих в их состав атомов. Учитывая малый размер атомов, одноатомную молекулу можно считать материальной точкой, имеющей только три поступательные степени свободы. Двухатомная молекула обладает тремя поступательными и двумя вращательными степенями свободы, т.к. поворот вокруг оси, соединяющей центры атомов (ось 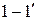 на рисунке 3.1) не приводит к изменению положения молекулы в пространстве и не требует отдельной координаты для описания. Молекула, состоящая из трех или большего числа атомов, имеет три поступательные и три вращательные степени свободы. Сведения о числе степеней свободы различных молекул обобщены в таблице 3.1.
на рисунке 3.1) не приводит к изменению положения молекулы в пространстве и не требует отдельной координаты для описания. Молекула, состоящая из трех или большего числа атомов, имеет три поступательные и три вращательные степени свободы. Сведения о числе степеней свободы различных молекул обобщены в таблице 3.1.
Таблица 3.1. Число степеней свободы различных молекул
| Число атомов в молекуле | iп | iв | i |
| (He, Ar и др.) | - | ||
| (О2, СО и др.) | |||
| 3 и больше (H2O, C6H6 и др.) |
Получим в явном виде зависимость внутренней энергии идеального газа от его макроскопических параметров. Молекулы идеального газа по определению не взаимодействуют на расстоянии. Следовательно, его внутренняя энергия равна суммарной кинетической энергии молекул и энергии движения и взаимодействия атомов в молекулах и ее можно найти как произведение средней энергии одной молекулы 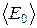 на число молекул газа
на число молекул газа 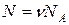 , где n - количество вещества. Используя теорему Больцмана (3.1) и уравнение Менделеева-Клапейрона (1.9), получим:
, где n - количество вещества. Используя теорему Больцмана (3.1) и уравнение Менделеева-Клапейрона (1.9), получим:
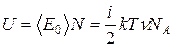 ,
,
 или
или 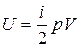 . (3.3)
. (3.3)
Date: 2015-05-08; view: 985; Нарушение авторских прав