
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамічні потенціали
|
|
В ізольованих системах зміна ентропії може служити критерієм напрямку самодовільних процесів. Проте, в металургійній практиці більшість процесів протікає не в ізольованих, а у відкритих системах. Для цих випадків в якості критеріїв напрямку процесів потрібні інші термодинамічні функції. Якщо процеси відбуваються при сталій температурі, то критерієм їх напрямку може служити робота. Важливим є те, що величина роботи дорівнює зміні деякої функції стану системи. Виведемо цю функцію для ізобарно-ізотермічного процесу.
Елементарна робота (dW) складається з об'ємної роботи (Wоб = PdV) і суми інших робіт – корисної роботи (W'), тобто
dW = PdV + W'.
Зваживши, що при оборотному процесі dQ = ТdS (4.1), запишемо на основі першого закону термодинаміки рівняння:
dU = dQ - dW = ТdS – PdV - dW';
-dW' = dU - ТdS + PdV. (5.1)
Враховуючи, що U і S – функції стану системи, а V – параметр стану, рівняння (5.1) можна подати у вигляді
-dW' = d(U – ТS + PV). (5.2)
Вводячи в (5.2) позначення: Н = U + PV і G = Н – ТS, одержуємо:
-dW' = dG;
W' = G1 – G2 = -DG, (5.3)
де G – функція стану системи, яка у 1875 році була запропонована Гіббсом у якості критерія напрямку ізобарно-ізотермічних процесів і одержала назву ізобарно-ізотермічного (коротко ізобарного) термодинамічного потенціалу системи або вільної енергії Гіббса.
Таким чином, в оборотних процесах максимальна корисна робота при ізобарно-ізотермічних процесах дорівнює зменшенню ізобарного потенціалу.
В необоротних процесах, де TdS > dQ (4.2), робота одержується меншою, ніж зміна ізобарного потенціалу
W' < -DG. (5.4)
Щоб визначити вплив температури і тиску на величину ізобарного потенціалу, диференцюємо рівняння
G = H – TS = U + PV – TS
за змінними Р і Т
dG = dU – TdS + SdT + PdV + VdP.
Оскільки,
dU = TdS – PdV - dW' (5.1),
то
dG = -SdT + VdP - dW'.
З цього рівняння при сталих Р і Т одержуємо в диференціальній формі рівняння (5.3). При відсутності корисної роботи одержуємо для оборотних процесів
dG = -SdT + VdP,
а для необоротних процесів
dG < -SdT + VdP.
Часткові похідні функції G:
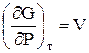 і
і 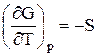
показують, що ізобарний потенціал зростає із збільшенням тиску і зменшується при підвищенні температури (рис. 5.1).

Рис. 5.1. Вплив температури і тиску на величину ізобарно-ізотермічного
потенціалу
Якщо процес відбувається необоротно, то при сталих тиску і температурі маємо (¶G)р,т < -dW', тобто одержуємо рівняння (5.4) в диференціальній формі. При відсутності корисної роботи одержуємо рівняння (¶G)р,т < 0.
Взагалі (¶G)р,т £ 0, звідки випливає, що ізобарний потенціал системи, яка знаходиться при сталих тиску і температурі не змінюється при оборотних процесах і зменшується при необоротних процесах.
Це можна переформулювати таким положенням: ізобарно-ізотермічний потенціал системи, що знаходиться при сталих тиску і температурі, прагне зменшитись у природних (самодовільних) процесах. Коли він досягає мінімального значення, то в системі встановлюється стан рівноваги.
Таким чином, умовами рівноваги для ізобарно-ізотермічних процесів є:
(¶G)р.т = 0; (¶2G)р.т > 0.
Останні співвідношення справедливі тільки в тому випадку, коли системою не виконуються інші види робіт, крім об'ємної.
Якщо вираз G = H – TS записати для ізобарно-ізотермічного процесу, то одержимо рівняння Гіббса-Гельмгольца
DG = DH - TDS, (5.5)
яке можна переписати таким чином
DH = DG + TDS.
Останнє рівняння свідчить, що зміна ентальпії системи складається з двох частин. Перша частина – це зміна ізобарного потенціалу, що дорівнює роботі, яку можна одержати у випадку проведення оборотного процесу. Друга частина TDS – це теплота, що при жодних умовах не може бути перетворена в роботу, але яка при оборотному процесі передається іншій системі або розсіюється в навколишньому середовищі.
З рівняння Гіббса-Гельмгольца видно, що навіть при здійсненні процесу (реакції) в ідеальних умовах оборотності неможливо перетворити всю ентальпію вихідних речовин в роботу. Ту частину енергії, що може бути перетворена в роботу (DG), називають вільною (роботоспроможною). TDS називають зв'язаною енергією (нероботоспроможною), оскільки вона не перетворюється в роботу.
Розмірковуючи аналогічно вищевикладеному, для ізохорно-ізотермічних процесів можна одержати
W' = -DF,
де F – функція стану системи, що називається ізохорно-ізотермічним (коротко ізохорним) термодинамічним потенціалом або вільною енергією Гельмгольца. Звичайно при проведенні металургійних процесів об'єм системи змінюється, тому ізохорний потенціал для металургів-практиків менш цікавий і більш докладно на його властивостях не зупиняємось.
Date: 2015-05-08; view: 722; Нарушение авторских прав