
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон Кірхгофа
|
|
Здебільшого металургійні процеси проводяться не при кімнатній (298 К), а при значно вищих температурах, оскільки реакції окислення-відновлення і розкладу при низьких температурах протікають дуже повільно.
Тому стає задача визначати теплові ефекти реакцій при будь-яких температурах. Це можна зробити за законом Кірхгофа. Вивід закону проведемо, використавши реакцію відновлення заліза з оксидів воднем
Fe2O3 + 3H2 = 2Fe + 3H2O.
Як вище вказувалось, тепловий ефект реакції – це зміна ентальпії системи у ході реакції. Тому
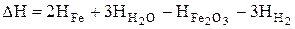 .
.
Візьмемо диференціал рівняння по температурі при сталому тиску і, пам'ятуючи рівняння (2.5), одержимо:

або
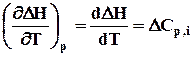 , (3.5)
, (3.5)
де DСр,і - зміна теплоємкості у ході реакції, яку можна визначити за рівнянням
DСр,і = ånіСр,кін.,і - ånіСр,поч.,і.
Рівняння (3.5) є законом Кірхгофа в диференціальній формі: температурний коефіцієнт ізобарного теплового ефекту реакції 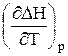 дорівнює зміні ізобарної теплоємкості реакції.
дорівнює зміні ізобарної теплоємкості реакції.
Аналіз рівняння (3.5) свідчить про складну залежність теплового ефекту реакції від температури.
Дійсно, при DСр,і > 0 і величина 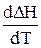 >0, тобто з ростом температури тепловий ефект реакції збільшується. Якщо DСр,і < 0, то і
>0, тобто з ростом температури тепловий ефект реакції збільшується. Якщо DСр,і < 0, то і 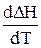 <0. отже з ростом температури тепловий ефект реакції зменшується. Нарешті, при DСр,і = 0 і величина
<0. отже з ростом температури тепловий ефект реакції зменшується. Нарешті, при DСр,і = 0 і величина 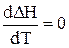 . У цьому випадку температура на тепловий ефект реакції не впливає.
. У цьому випадку температура на тепловий ефект реакції не впливає.
При зміні температури теплоємкості реагуючих речовин змінюються не однаково, тому можливі випадки, коли для реакції при одних температурах DСр,і > 0, а при других - DСр,і < 0 і навпаки. У цьому разі залежність теплового ефекту від температури описується кривими, наведеними на рис. 3.1.
Закон Кірхгофа в диференціальній формі дозволяє лише якісно оцінити вплив температури на тепловий ефект реакції. Щоб мати змогу кількісно обчислювати теплові ефекти при будь-яких температурах, треба проінтегрувати рівняння (3.5) в межах температур від Т1 до Т2:
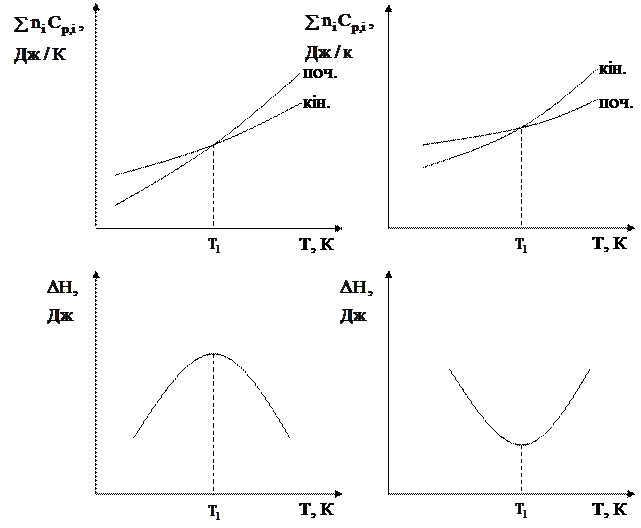
Рис. 3.1. Залежність теплового ефекту реакції від температури в умовах
зміни знаку величини åniCp,i
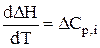 ; dDH = DCр,і × dT;
; dDH = DCр,і × dT;
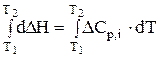 ;
;
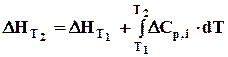 . (3.6)
. (3.6)
Рівняння (3.6) відоме як закон Кірхгофа в інтегральній формі: тепловий ефект реакції при будь-якій температурі (Т2) дорівнює тепловому ефекту цієї реакції при певній температурі (Т1), плюс інтеграл Кірхгофа.
На практиці найчастіше беруть Т1 = 298 К, бо стандартні теплові ефекти багатьох реакцій відомі, а при потребі їх можна визначити за законом Гесса. Тому закон Кірхгофа можна представити рівнянням
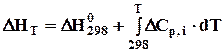 . (3.7)
. (3.7)
Розв'язати інтеграл Кірхгофа можна двома методами. Перший метод полягає в використанні емпіричного ступеневого ряду теплоємкості
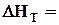
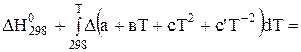
 , (3.8)
, (3.8)
де Dа, Dв, Dс і Dс' – зміна коефіцієнтів емпіричного ступеневого ряду у ході реакції, яку можна визначити за рівнянням:
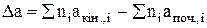 ;
;
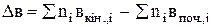 і т.д.
і т.д.
При обчисленні інтегралу Кірхгофа за другим методом користуються функціями тепловмісту реагуючих речовин
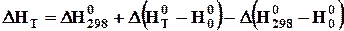 , (3.9)
, (3.9)
де 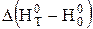 і
і 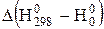 - зміна функцій тепловмісту у ході реакції, яку можна визначити за рівняннями:
- зміна функцій тепловмісту у ході реакції, яку можна визначити за рівняннями:
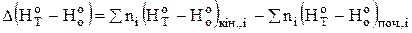 ;
;
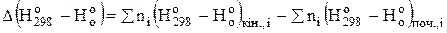 . (3.10)
. (3.10)
Якщо в інтервалі температур від 298 до Т К є фазові перетворення, обчислення теплового ефекту треба вести за рівнянням (3.9), в якому всі можливі фазові перетворення враховані. При користуванні рівнянням (3.8) необхідно врахувати теплоти фазових перетворень, а також зміну теплоємкості речовини, що при цьому відбувається. У цьому випадку рівняння (3.8) набуває вигляду
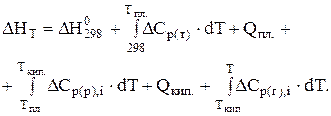 (3.11)
(3.11)
Задача 3.1. Визначити теплові ефекти реакції (Х)
Х. Fe3O4 + 4CO = 3Fe + 4CO2,
що має місце при виплавці чавуну у доменному процесі, при 298 і 1000 К. Зробити висновки про вплив температури на тепловий ефект реакції.
Розв'язання. Стандартний тепловий ефект реакції визначимо шляхом алгебраїчного підсумовування допоміжних реакцій, які підбираємо, користуючись табл. Д.3 і правилами, наведеними на стор. 26:
 І. Fe3O4 + CО = 3FeO + CO2 +1
І. Fe3O4 + CО = 3FeO + CO2 +1 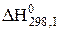 = 39,60 кДж;
= 39,60 кДж;
ІІ. FeO + CO = Fe + CO2 +3 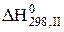 = -18,13 кДж.
= -18,13 кДж.
Перевірка. Підсумовуючи допоміжні рівняння за (3.3), одержуємо
Fe3O4 + CO + 3FeO + 3CO = 3FeO + CO2 + 3Fe + 3CO2.
Після скорочення і об'єднання однакових речовин, маємо рівняння
Fe3O4 + CO = 3Fe + CO2,
що відповідає базовому рівнянню (Х). Перевірка позитивна. Тепловий ефект визначаємо за рівнянням (3.4)
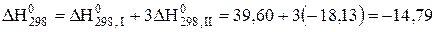 кДж.
кДж.
Оскільки 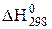 <0, то при 298 К досліджувана реакція проходить з виділенням теплоти (екзотермічна реакція).
<0, то при 298 К досліджувана реакція проходить з виділенням теплоти (екзотермічна реакція).
Тепловий ефект при 1000 К визначимо за рівнянням (3.8)
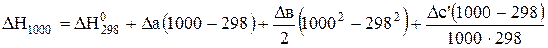 .
.
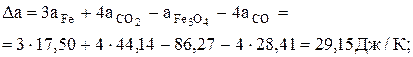
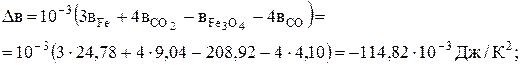
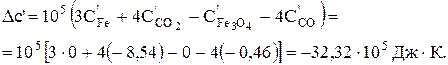
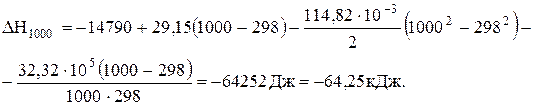
DН1000 < 0, отже реакція і при 1000 К проходить з виділенням теплоти (екзотермічна). При зростанні температури від 298 до 1000 К тепловий ефект реакції зменшується від –14,79 до –62,30 кДж.
Задача 3.2. Визначити тепловий ефект реакції
Fe3O4 + 4CО = 3Fe + 4CO2
при 1100 К. Відомо, що при 1033 К залізо з a-форми переходить в b-форму і теплота переходу (Qпер.) становить 2,76 кДж/моль.
Роз'язання. Тепловий ефект реакції визначаємо за рівнянням (3.11), яке в цьому випадку має вигляд
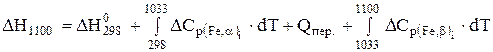 .
.
Візьмемо Dа, Dв і Dс' до перетворення заліза з попередньої задачі, а після перетворення – розрахуємо по аналогії:
Dа = 3×37,68+4×44,14-86,27-4×28,41 = 77,69 Дж/К;
Dв = 10-3(3×0+4×9,04-208,92-4×4,10) = -189,16 Дж/К2;
Dс' = 105[3×0+4×(-8,54)-0-4×(-0,46)] = -32,32×105 Дж×К.
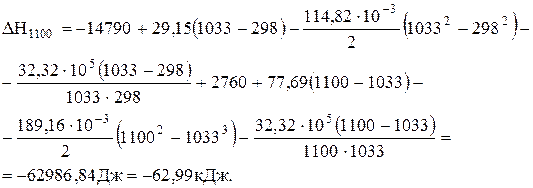
Задача 3.3. Марганець одержують відновленням його оксидів алюмінієм. Реакція природнього MnO2 з алюмінієм проходить дуже бурхливо, тому MnO2 поперед прожарюють до Mn2O3, який реагує з алюмінієм більш спокійно
3Mn3O4 + 8Al = 9Mn + 4Al2O3.
Визначити теплові ефекти реакції при 298 і 1000 К. Зробити висновок про вплив температури на тепловий ефект реакції.
Розв'язання. Стандартний тепловий ефект реакції визначимо за рівнянням (3.2), взявши 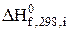 з табл. Д.2.
з табл. Д.2.
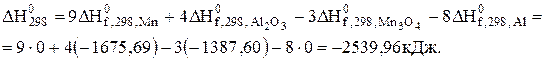
Тепловий ефект при 1000 К знайдемо за рівнянням (3.9), скориставшись даними табл. Д.4.
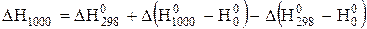 ;
;
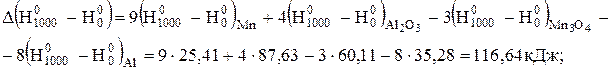
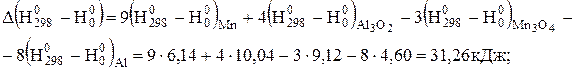
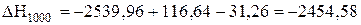 кДж.
кДж.
Таким чином, реакція відновлення марганцю протікає з виділенням теплоти і при 298, і при 1000 К, тобто є екзотермічною. З підвищенням температури тепловий ефект реакції дещо збільшується.
Date: 2015-05-08; view: 781; Нарушение авторских прав