
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Самодовільних процесів. Ентропія
|
|
Перший метод – метод факторів інтенсивності. Інтенсивними факторами можуть бути тиск, температура тощо. За цим методом самодовільні процеси можуть проходити в напрямку вирівнювання певного фактора інтенсивності. Рівновазі відповідає однакове значення цього фактора у всіх частинах системи.
Метод факторів інтенсивності є обмеженим. Він не придатний для визначення напрямку процесів в однорідних системах, де фактори інтенсивності однакові, наприклад, в хімічних реакціях.
Більш загальним є метод термодинамічних функцій. Він полягає в тому, що для конкретних умов існування певної термодинамічної системи підбирається термодинамічна функція стану системи, яка при протіканні самодовільного процесу збільшується (або зменшується) і в стані рівноваги досягає екстремального значення.
Клаузіус показав, що для ізольованих систем такою функцією може бути ентропія (S).
Ентропія системи – це функція стану системи, диференціал якої (dS) для елементарного рівноважного (оборотного) процесу дорівнює відношенню нескінченно малої кількості теплоти (dQ), поглинутою системою, до абсолютної температури системи
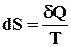 . (4.1)
. (4.1)
Для нерівноважного (необоротного, самодовільного) процесу
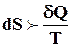 . (4.2)
. (4.2)
Ентропія залежить від хімічної природи речовин і температури. Згідно з постулатом Планка, ентропія індивідуальної кристалічної речовини при абсолютному нулі дорівнює нулю: Sо = 0. Із зростанням температури ентропія збільшується, а при фазових перетвореннях збільшується стрибкоподібно. Ентропію речовини при стандартних умовах позначають 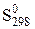 . Для багатьох речовин стандартна ентропія визначена і наводиться у довідниках (табл. Д.2). Одиницею вимірювання ентропії є Дж/(моль×К).
. Для багатьох речовин стандартна ентропія визначена і наводиться у довідниках (табл. Д.2). Одиницею вимірювання ентропії є Дж/(моль×К).
Для ізольованих систем, де відсутній обмін теплотою з навколишнім середовищем, dQ = 0. Тоді з рівнянь (4.1-4.2) випливає, що для оборотних процесів dS = 0 (тобто ентропія стала), а для необоротних, самодовільних процесів dS > 0 (тобто ентропія у ході процесу зростає).
Таким чином, визначивши зміну ентропії при процесі, можна робити висновок про напрямок процесу. Враховуючи, що ентропія – функція стану системи і dS є повним диференціалом ентропії, можна сформулювати правила визначення напрямку процесів:
- якщо DS > 0 (ентропія зростає), то процес протікає самодовільно;
- якщо DS < 0 (ентропія зменшується), то прямий процес самодовільно не проходить. Самодовільно протікає зворотний процес;
- якщо DS = 0 (ентропія не змінюється), то система знаходиться у стані рівноваги.
За допомогою поняття ентропії можна об'єднати перший і другий закони термодинаміки.
З другого закону термодинаміки випливає, що
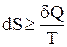 .
.
Звідси dS £ T×dS. Підставимо це значення в рівняння першого закону - dQ = dU + dW і одержимо:
Т×dS ³ dU + dW
або
Т×dS - dU ³ dW. (4.3)
З рівняння (4.3) видно, що максимальна робота має місце лише при оборотних процесах (теплота у цьому разі мінімальна).Для необоротних процесів, навпаки, теплота максимальна, а робота мінімальна.
Date: 2015-05-08; view: 676; Нарушение авторских прав