
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методи розрахунків ентропії речовин і зміни ентропії
|
|
процесів (реакцій)
Зміну ентропії при фазовому перетворенні речовини (DSф.п.) можна визначити за рівнянням
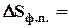
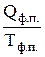
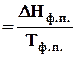 , (4.1)
, (4.1)
де DНф.п.(Qф.п.) – теплота фазового перетворення, Дж/моль; Тф.п. – температура фазового перетворення, К.
Ентропію речовини при будь-якій температурі можна визначити з наступних міркувань:
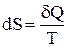 ;
; 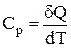 ;
;
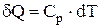 ;
; 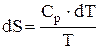 ;
;
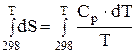 ;
; 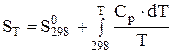 . (4.5)
. (4.5)
Рівняння (4.5) можна розв'язати як за допомогою емпіричного ступеневого ряду
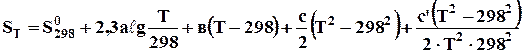 , (4.6)
, (4.6)
так і через функції тепловмісту і приведеної енергії Гіббса
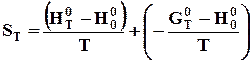 , (4.7)
, (4.7)
де 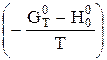 - приведена енергія Гіббса, Дж/(моль×К);
- приведена енергія Гіббса, Дж/(моль×К); 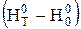 - тепловміст, кДж/моль.
- тепловміст, кДж/моль.
Приведена енергія Гіббса для багатьох речовин наводиться в довідниках (табл. Д.4).
Якщо в інтервалі температур від 298 до Т К має місце фазове перетворення, треба користуватись рівнянням (4.7), бо рівняння (4.6) у цьому випадку набуває вигляду
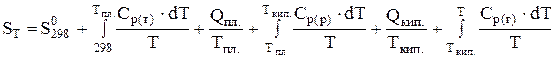 . (4.8)
. (4.8)
Як вже вказувалось, для визначення напрямку хімічної реакції в ізольованій системі треба розраховувати зміну ентропії реакції (DS). Розглянемо цей випадок на прикладі одержання цинку пірометалургійним методом. У цьому випадку цинкову руду випалюють до оксиду цинку, останній змішують з коксом і нагрівають до 1370-1470 К. При цьому відбувається реакція
ZnO + C = Zn + CO,
зміна ентропії якої при сталій температурі буде дорівнювати
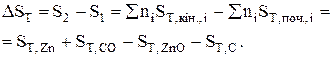
При визначенні SТ,і за допомогою емпіричного ступеневого ряду теплоємкості одержимо рівняння
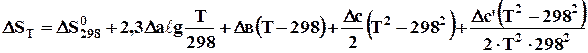 , (4.9)
, (4.9)
де 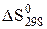 - зміна стандартної ентропії реакції, Дж/К; Dа, Dв, Dс і Dс' – зміна коефіцієнтів емпіричного ступеневого ряду.
- зміна стандартної ентропії реакції, Дж/К; Dа, Dв, Dс і Dс' – зміна коефіцієнтів емпіричного ступеневого ряду.
Якщо ж визначити SТ,і через тепловміст і приведену енергію Гіббса, зміна ентропії реакції виражається рівнянням
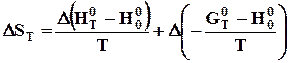 , (4.10)
, (4.10)
де 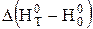 - зміна тепловмісту у ході реакції, кДж;
- зміна тепловмісту у ході реакції, кДж; 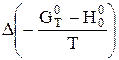 - зміна приведеної енергії Гіббса, Дж/К.
- зміна приведеної енергії Гіббса, Дж/К.
Наведені рівняння визначення DSТ (4.9-4.10) придатні як для оборотних, так і необоротних процесів. Це є наслідком властивості ентропії як функції стану системи, бо зміна функції стану від шляху процесу не залежить.
Date: 2015-05-08; view: 635; Нарушение авторских прав