
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Константа хімічної рівноваги
|
|
Як вже зазначалось, стан рівноваги настає не від того, що хімічна реакція зупинилась, а тому що швидість прямої і зворотної реакцій стають рівними.
Розглянемо оборотну хімічну реакцію в загальному вигляді
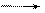 аА + вВ еЕ + dД.
аА + вВ еЕ + dД.
На підставі закону діючих мас, формулювання і кінетичний вивід якого були дані в 1867 році Гульбергом і Вааге, швидкість реакції пропорційна концентраціям (тискам для газів) реагуючих речовин, взятих у ступенях, рівних стехіометричним коефіцієнтам в рівнянні хімічної реакції.
Виходячи з цього, швидкість прямої реакції uпр., що протікає зліва направо, дорівнює
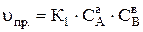 ,
,
а швидкість зворотної реакції (uзв.), що протікає справа наліво, становить
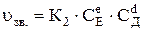 ,
,
де К1 і К2 – константи швидкості прямої і зворотної реакцій; СА і СВ – рівноважні концентрації початкових речовин А і В, кмоль/м3; СЕ і СД – рівноважні концентрації кінцевих речовин Е і Д, моль/м3; а, в, е і d – відповідно число моль реагуючих речовин А, В, Е і Д за рівнянням реакції.
В момент рівноваги швидкості прямої і зворотної реакцій рівні між собою:
uпр. = uзв.;
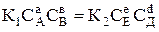 .
.
Константи швидкості прямої і зворотної реакцій є сталими величинами для кожної оборотної реакції. Тому відношення цих констант також стала величина (К), яка називається константою хімічної рівноваги реакції і визначається рівнянням
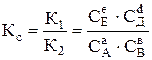 . (6.1)
. (6.1)
Таким чином, константою рівноваги хімічної реакції називається добуток рівноважних концентрацій кінцевих речовин, поділений на добуток рівноважних концентрацій початкових речовин, причому всі концентрації взяті у ступенях, які однакові із стехіометричними коефіцієнтами реакції.
Константа рівноваги не залежить від концентрацій початкових і кінцевих речовин, але залежить від природи речовин і температури.
Для реакцій, що протікають між газами, константу рівноваги визначають через парціальні тиски реагуючих речовин за таким рівнянням
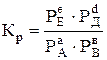 , (6.2)
, (6.2)
де РА і РВ – рівноважні парціальні тиски початкових газів А і В, Па; РЕ і РД – рівноважні парціальні тиски кінцевих газів Е і Д, Па; а, в, е і d – відповідно число моль реагуючих і утворених газів А, В, Е і Д за рівнянням реакції.
Для оборотної реакції, що протікає в концентрованих розчинах (або між реальними газами), константу рівноваги визначають через активності (або фугітивності) реагуючих речовин, наприклад, рівнянням
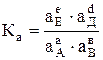 , (6.3)
, (6.3)
де аА, аВ, аЕ і аД – відповідно активності реагуючих речовин А, В, Е і Д.
Така константа рівноваги називається термодинамічною константою рівноваги.
Для оборотної гетерогенної реакції

 аА(г) + вВ(т) еЕ(г) + dД(т),
аА(г) + вВ(т) еЕ(г) + dД(т),
де А(г) і Е(г) – газоподібні речовини; В(т) і Д(т) – тверді речовини, константа рівноваги дорівнює
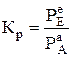 , (6.4)
, (6.4)
де РА і РЕ –рівноважні парціальні реагуючих газів А і Е.
Парціальні тиски твердих речовин при даній температурі сталі і не залежать від маси твердих речовин. Тому вони не входять до рівняння константи рівноваги.
Для оборотних реакцій розкладу, наприклад,


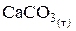 СаО(т) + СО2(г)
СаО(т) + СО2(г)
константа рівноваги дорівнює
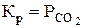 ,
,
де 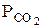 - тиск оксиду вуглецю (IV), що перебуває в рівновазі з карбонатом кальцію.
- тиск оксиду вуглецю (IV), що перебуває в рівновазі з карбонатом кальцію.
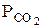 називається тиском (пружністю) дисоціації карбонату кальцію. Температура, при якій тиск (пружність) дисоціації карбонату дорівнює зовнішньому тиску (1,013×105 Па), називається температурою розкладу карбонату кальцію.
називається тиском (пружністю) дисоціації карбонату кальцію. Температура, при якій тиск (пружність) дисоціації карбонату дорівнює зовнішньому тиску (1,013×105 Па), називається температурою розкладу карбонату кальцію.
Термічний розклад оксидів, наприклад, FeO, протікає за рівнянням
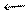
 2FeO 2Fe + O2
2FeO 2Fe + O2
і константа рівноваги реакції дорівнює
Кр = 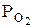 ,
,
де 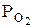 - тиск кисню, що перебуває в рівновазі з оксидом заліза (ІІ) і називається тиском (пружністю) дисоціації оксиду заліза (ІІ).
- тиск кисню, що перебуває в рівновазі з оксидом заліза (ІІ) і називається тиском (пружністю) дисоціації оксиду заліза (ІІ).
Температура, при якій пружність дисоціації оксиду дорівнює зовнішньому тиску, називається температурою розкладу оксиду.
Часто концентрація (особливо при реакціях між твердими речовинами, або твердими і рідкими) виражається через мольні частки – N. Мольна частка даної речовини (Ni) дорівнює відношенню числа моль даної речовини (ni) до загального числа моль всіх компонентів у системі (åni)
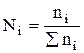 .
.
У такому разі константу рівноваги виражають через мольні частки реагуючих речовин
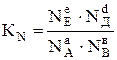 , (6.5)
, (6.5)
де NА, NB, NE і NД – мольні частки початкових (вихідних) і кінцевих (продуктів) речовин. Мольна частка безрозмірна величина.
Якщо при проходженні реакції не відбувається зміни моль газоподібних речовин, то
Кс = Кр = КN.
Для реакцій, що супроводяться зміною числа моль газоподібних речовин, чисельні значення констант рівноваги, що виражені різними способами, розрізняються. Зв'язок між ними легко встановити, використавши рівняння Менделєєва-Клапейрона для суміші ідеальних газів:
Pi = CiRT;
Рi = NiPзаг., (6.6)
де Рі – парціальний тиск даного газу, Па; Рзаг. – загальний тиск в системі, Па; R – універсальна газова стала, 8,314 Дж/(моль×К); Т – температура, К; Сі і Ni – концентрація (моль/м3) і мольна частка відповідно.
Враховуючи (6.6), одержуємо співвідношення
Кр = Кс(RT)Dn = KN(Рзаг.)Dn, (6.7)
де Dn – зміна числа моль газоподібних речовин у реакції (Dn = n2 – n1, де n1 – число моль вихідних газоподібних речовин; n2 – число моль кінцевих газоподібних речовин реакції).
Числове значення константи рівноваги залежить від хімічної природи реагуючих речовин і температури, але не залежить від концентрації (Р, N) реагуючих речовин. KN залежить також від загального тиску в системі.
При змішуванні всіх реагуючих речовин (початкових і кінцевих) перебіг реакції може відбуватись у бік утворення продуктів реакції або в бік утворення вихідних речовин. Чисельне значення константи рівноваги є мірою (критерієм) термодинамічної імовірності тієї чи іншої реакції.
Аналізуючи рівняння (6.1-6.5), можна зробити висновок: чим більша величина константи рівноваги, тим більша концентрація (Р, N) продуктів реакції, порівняно з вихідними речовинами, тобто тим більше рівновага реакції зміщена праворуч. І навпаки. Якщо концентрації вихідних і кінцевих речовин однакові (тобто зміщення реакції не відбувається), константа рівноваги дорівнює одиниці.
Таким чином, при визначенні напрямку хімічної реакції можна користуватися правилом:
- якщо К > 1, то самодовільно протікає пряма реакція, при К ³ 105 – пряма реакція проходить на 100%;
- якщо К < 1, то самодовільно проходить зворотна реакція, при К£10-5 – зворотна реакції проходить на 100%;
- якщо К = 1, швидкості прямої і зворотної реакцій однакові і з будь-якого боку (від вихідних чи від кінцевих речовин) реакція проходить на 50%.
Date: 2015-05-08; view: 703; Нарушение авторских прав