
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ентропія і імовірність
|
|
Розглядаючи зміну ентропії в різних процесах, можна помітити, що збільшення ентропії завжди супроводжується зростанням хаотичності молекулярного стану. Наприклад, перехід системі з кристалічного в рідкий або газоподібний стани супроводжується зменшенням упорядкування і зростанням хаотичності у розподілі молекул. Одночасно зростає і ентропія системи.
Макроскопічний стан системи є сукупністю мікростанів, в яких беруть участь молекули з різними ознаками. Імовірність кожного макростану пропорційна числу мікростанів, через які він здійснюється. Це число називають термодинамічною імовірністю (W). У 1896 році Больцман дав визначенню ентропії як термодинамічної імовірності
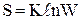 , (4.11)
, (4.11)
де К – стала Больцмана (1,38×10-23 Дж×К-1).
Поняття термодинамічної імовірності дозволяє уточнити зміст другого закону термодинаміки. З точки зору статичної термодинаміки, процеси, що наближають систему до стану рівноваги, відповідають переходу системи від менш імовірних станів до більш імовірних. Процеси, що віддаляють систему від стану рівноваги не є неможливими, а є менш імовірними.
Розрахунки свідчать, що для систем, які складаються з великої кількості частинок, більш імовірний напрямок самодовільного процесу абсолютно неминучий, а процеси, що виводять систему з стану рівноваги – практично неможливі. Чим з меншого числа частинок складається система, тим менш строго дотримується це ствердження. Отже другий закон термодинаміки виконується лише для систем з великою кількістю частинок, тобто має статистичний характер.
Задача 4.1. Визначити ентропію 10 кг міді при 2000 К, якщо температура плавлення міді 1356 К, температура кипіння – 2843 К, теплота плавлення – 12,98 кДж/моль. Необхідні для розрахунку дані взяти з таблиць довідника.
Розв'язання. Ентропію міді при 2000 К можна обчислити за рівнянням (4.8)
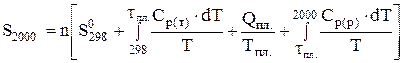 .
.
Враховуючи рівняння (4.6), ентропія 10 кг міді при 2000 К дорівнюватиме

Задача 4.2. По зміні ентропії визначити напрямок реакції одержання цинку пірометалургійним методом за реакцією
ZnO +C = Zn + CO
в ізольованій системі при 1000 К. Необхідні для розрахунків дані взяти з таблиць довідника.
Розв'язання. Зміну ентропії реакції можна знайти за рівнями (4.10)
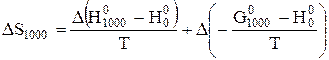 .
.
Користуючись даними табл. Д.4, визначимо:
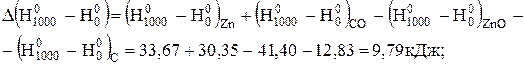
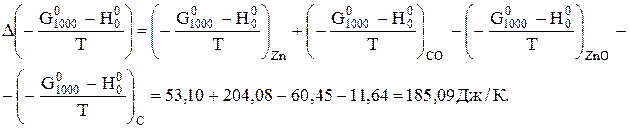
Отже, зміна ентропії реакції дорівнюватиме
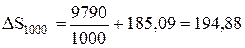 Дж/К.
Дж/К.
Оскільки DS1000 > 0 (ентропія зростає), то реакція при 1000 К в ізольованій системі проходитиме самодовільно в прямому напрямку.
Date: 2015-05-08; view: 620; Нарушение авторских прав