
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Загальні положення. Тепловий ефект реакції
|
|
При хімічних перетвореннях відбувається зміна хімічних зв'язків, що призводить до перерозподілу енергії між молекулами. Загальним результатом такого перерозподілу енергії в системі під час хімічної реакції є виділення або поглинання теплоти. Вивченням теплот хімічних реакцій займається термохімія. В коло її задач входять: експериментальне визначення теплових ефектів, їх порівняння і систематика, а також установлення закономірностей, що дозволяють визначити теплові ефекти процесів, в яких їх експериментальне визначення неможливе. Термохімія має як теоретичне, так і практичне значення. Знання теплових ефектів необхідне для розрахунків хімічних рівноваг, а в технологічній практиці теплові ефекти потрібні при складанні теплових балансів металургійних процесів.
З першого закону термодинаміки випливає, що для ізохорних процесів QV = DU (1.4), а для ізобарних процесів Qp = DН (1.6). Таким чином, тепловим ефектом реакції називається зміна ентальпії при сталому тиску або внутрішньої енергії при сталому об'ємі системи, розрахована на стехіометричні кількості реагуючих речовин.
Зміну ентальпії називають ізобарним тепловим ефектом реакції (DН), а зміну внутрішньої енергії – ізохорним тепловим ефектом (DU). Співвідношення між ними описуються рівняннями:
DН = DU + PDV;
DH = DU + DnRT,
де Dn = n2 – n1 – зміна числа моль газоподібних речовин в реакції; n1 і n2 – число моль початкових та кінцевих газів; R – універсальна газова стала, Дж/(моль×К); Т – температура, при якій протікає реакція, К.
Для систем, в яких реагують лише конденсовані (тверді і рідкі) речовини, зміна об'єму мала, РDV ® 0 і DН» DU. При 0 К DnRT = 0 і DHo = DUo.
Тепловий ефект реакції залежить від природи і агрегатного стану реагуючих речовин та температури. Часто користуються стандартним тепловим ефектом реакції - 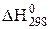 . Це тепловий ефект реакції при стандартних умовах: Т = 298 К, Р = 1,013×105 Па. Вважають також, що реакція протікає з участю речовин, стійких за даних умов. Стандартні теплові ефекти багатьох реакцій визначені і наводяться в довідниках (табл. Д.3). В системі одиниць СІ за одиницю вимірювання теплового ефекту реакції взято джоуль (Дж).
. Це тепловий ефект реакції при стандартних умовах: Т = 298 К, Р = 1,013×105 Па. Вважають також, що реакція протікає з участю речовин, стійких за даних умов. Стандартні теплові ефекти багатьох реакцій визначені і наводяться в довідниках (табл. Д.3). В системі одиниць СІ за одиницю вимірювання теплового ефекту реакції взято джоуль (Дж).
Якщо реакція протікає з виділенням теплоти, її називають екзотермічною. Для неї DН < 0. Якщо ж реакція супроводжується поглинанням теплоти, її називають ендотермічною. Для ендотермічних реакцій DН > 0.
Тепловий ефект і теплота реакції не завжди співпадають. Дійсно, для ізобарно-ізотермічного процесу можна записати такі рівності:
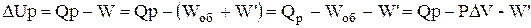 ;
;
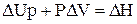 ;
; 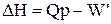 .
.
Таким чином, тільки при умовах, коли корисна робота процесу W' дорівнює нулю, тепловий ефект і теплота процесу співпадають. Якщо ж W' ¹ 0, DН ¹ Qр.
В термохімії користуються так званими термохімічними рівняннями. Це рівняння хімічних реакцій з обов'язковим наведенням величин теплових ефектів, наприклад
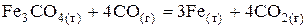 ,
, 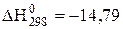 кДж.
кДж.
З огляду на те, що теплові ефекти реакцій залежать від агрегатного стану і кристалічної модифікації реагуючих речовин, в термохімічних рівняннях необхідно приводити відповідні вказівки.
З термохімічними рівняннями можна проводити різні математичні вправи (додавання, віднімання і т.д.). Такі ж математичні вправи здійснюють і з величинами теплових ефектів реакцій.
Date: 2015-05-08; view: 772; Нарушение авторских прав