
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические основы. Скорость химической реакции представляет собой число элементарных актов этой реакции в единицу времени в единице объёма для гомогенных реакций или на
|
|
Скорость химической реакции представляет собой число элементарных актов этой реакции в единицу времени в единице объёма для гомогенных реакций или на единице площади поверхности раздела фаз для гетерогенных реакций.
Из множества молекул при столкновении химически взаимодействуют только те, энергия которых не ниже энергии активации. Доля таких молекул, они называются активными, а также величина энергии активации (высота активационного барьера) определяют величину скорости химической реакции.
На практике это проявляется в зависимости скорости реакции от природы и концентрации реагирующих веществ, температуры, природы реакционной среды (например, природы растворителя) и присутствия катализаторов. Каждый из указанных факторов так или иначе влияет либо на долю активных молекул, либо на высоту активационного барьера.
Зависимость скорости реакции от температуры выражается формулой Вант-Гоффа  , где
, где 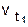 - скорость реакции при температуре t1 ,
- скорость реакции при температуре t1 , 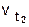 - скорость реакции при температуре t2 , g - температурный коэффициент реакции. Например, при повышении температуры от 20° до 60° скорость реакции, температурный коэффициент которой равен 3, возрастает в
- скорость реакции при температуре t2 , g - температурный коэффициент реакции. Например, при повышении температуры от 20° до 60° скорость реакции, температурный коэффициент которой равен 3, возрастает в 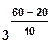 = 34 = 81 раз.
= 34 = 81 раз.
Согласно закону действия масс изменение концентрации реагирующих веществ вызывает пропорциональное изменение скорости реакции. Так, для реакции
а А + в В ¾® с С + d D
скорость будет пропорциональна произведению концентрации веществ А и В, взятых в степенях, соответствующих стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции: 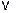 = k [A]a•[B] b.
= k [A]a•[B] b.
При этом концентрации твёрдых веществ считаются практически неизменными и в явном виде не включаются в выражение для скорости. Например, скорость реакции железа с соляной кислотой
Fe (тв) + 2HCl (р-р) = FeCl2 (р-р) + H2 (г)
выражается только черезконцентрацию кислоты:
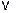 = k [HCl]2.
= k [HCl]2.
При увеличении концентрации HCl, например, в 3 раза, скорость этой реакции возрастает в 32 раза, т.е. в 9 раз.
Для газообразных веществ изменения концентраций можно достичь, изменяя внешнее давление в реакционной системе. Например, при повышении давления в 4 раза в системе 2SO2 (г) + O2 (г) = 2SO3 (г) (*)
скорость этой реакции 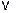 = k [SO2]2•[O2] возрастёт в 42• 4 = 64 раза, так как при этом так же в четыре раза увеличится концентрация каждого газообразного компонента.
= k [SO2]2•[O2] возрастёт в 42• 4 = 64 раза, так как при этом так же в четыре раза увеличится концентрация каждого газообразного компонента.
Большинство химических реакций является обратимыми: одновременно протекает прямая (слева направо) и обратная (справа налево) реакции. В момент выравнивания скоростей этих реакций в системе наступает химическое равновесие

 а А + в В с С + d D,
а А + в В с С + d D,
характеризуемое константой равновесия:
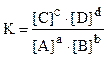 .
.
Например, константа равновесия для реакции (*)
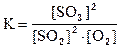 .
.
Следует учесть, что в случае гетерогенных равновесий, например, MgSО3 (тв) = MgО (тв) + SО2 (г) концентрации
твёрдых веществ в явном виде не записывают в выражении для константы химического равновесия: К = [SO2].
Направление смещения равновесия определяется стремлением системы противодействовать вмешательству извне (принцип Ле Шателье).
Так, нагревание смещает равновесие в сторону эндотермической реакции, происходящей с поглощением тепла. Охлаждение - в сторону экзотермической реакции, сопровождающейся выделением тепла.
Повышение давления вызывает смещение равновесия в сторону реакции, протекающей с уменьшением объёма или числа молей газообразных веществ. Напротив, понижение давления - в сторону реакции с увеличением объёма (числа молей газообразных веществ).
Увеличение концентрации исходных веществ сдвигает равновесие вправо, а увеличение концентрации продуктов взаимодействия - влево. В общем случае повышение концентрации какого-либо компонента реакционной системы смещает равновесие в сторону той реакции, в которой этот компонент расходуется.
Например, в системе (*) прямая реакция экзотермична, протекает с уменьшением числа молей газообразных веществ, из трёх молей исходных газов образуются два моля газообразного продукта. Поэтому для смещения равновесия слева направо, в сторону прямой реакции, необходимо понизить температуру по сравнению с равновесной, повысить давление и концентрации SO2 и О2 или понизить концентрацию SO3 (отводить его из сферы реакции по мере образования).
Date: 2015-05-04; view: 682; Нарушение авторских прав