
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические основы. Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстанови-тельными
|
|
Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстанови-тельными. Окисление - это процесс отдачи электронов, сопровождающийся повышением степени окисления элемента. Восстановление - это процесс присоединения электронов, сопровождающийся понижением степени окисления элемента. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, - окислителем («восстановитель окисляется, окислитель восстанавливается»).
Степенью окисления называется условный заряд атома в соединении, рассчитанный из предположения, что все связи в нём ионного типа. При расчёте степеней окисления нужно учитывать следующее.
1. В простых веществах степени окисления элементов всегда равны нулю: Feo, P4o, Heo, O2o, N2o, H2o, Co.
2. Водород в соединениях с неметаллами имеет степень окисления +1: H+1Cl, H+12O, NaOH+1, а в соединениях с металлами - -1: NaH-1, Ca H-12.
3. Кислород в соединениях характеризуется степенью окисления -2: FeO-2, P2O-25, H2SO-24, Ca(NO-23)2. Исключение составляют пероксиды (H+12О-12, Ва+2О-12) и фторид кислорода (О+2F-12).
4. Элементы главных подгрупп I, II и III групп периодической системы имеют постоянные степени окисления, равные номеру группы: Na+1Cl, Mg+2O, Al+32(SO4)3.
5. Сумма положительных и отрицательных «зарядов» на всех атомах в молекуле равна нулю.
Для элементов с непостоянной степенью окисления её значение можно подсчитать по формуле соединения. Определим в качестве примера степень окисления серы в H2S, SO2, SO3, H2SO3, H2SO4. Обозначим её через c. Зная, что степень окисления водорода равна +1, а кислорода -2, получим:
H2S c(S) + 2(+1) = 0, откуда c(S) = -2
SO2 c(S) + 2(-2) = 0, откуда c(S) = +4
SO3 c(S) + 3(-2) = 0, откуда c(S) = +6
H2SO3 c(S) + 2(+1) + 3(-2) = 0, откуда c(S) = +4
H2SO4 c(S) + 2(+1) + 4(-2) = 0, откуда c(S) = +6
Окислительно-восстановительные свойства веществ зависят от величин степеней окисления входящих в него атомов. Атом в высшей степени окисления может только отдавать электроны, то есть может быть только окислителем (S+6 + 2 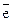 ¾® S+4). Атом в низшей степени окисления может только отдавать электроны, то есть может быть только восстановителем (S-2 - 2
¾® S+4). Атом в низшей степени окисления может только отдавать электроны, то есть может быть только восстановителем (S-2 - 2 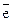 ¾® So). Если степень окисления атома промежуточная, он может как отдавать, так и принимать электроны, проявляя окислительно-восстановительную двойственность. Например, в реакции SO2 + O2 ¾® SO3 оксид серы (IV) за счёт атома S(+4) проявляет свойства восстановителя, подвергаясь окислению:
¾® So). Если степень окисления атома промежуточная, он может как отдавать, так и принимать электроны, проявляя окислительно-восстановительную двойственность. Например, в реакции SO2 + O2 ¾® SO3 оксид серы (IV) за счёт атома S(+4) проявляет свойства восстановителя, подвергаясь окислению:
S+4 - 2 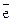 ¾® S+6.
¾® S+6.
А в реакции SO2 + Н2S ¾® So + Н2О оксид серы (IV) проявляет свойства окислителя, подвергаясь восстановлению: S+4 + 4 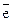 ¾® So.
¾® So.
Кислород проявляет положительную степень окисления только в соединении со фтором, поэтому нулевая сте-
пень окисления для кислорода практически является максимальной. Следовательно, свободный кислород может быть только окислителем и подвергаться восстановлению: Oo2 + 4 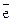 ¾® 2О-2.
¾® 2О-2.
Коэффициенты в уравнении окислительно-восстанови-тельной реакции можно расставить с помощью метода электронного баланса. Метод основан на том, что общее число электронов, отдаваемых восстановителями и принимаемых окислителями в одной и той же реакции должно быть одинаковым. При этом рекомендуется придерживаться следующих правил.
1. Для данной схемы реакции определить окислитель и восстановитель, подсчитав степени окисления элементов до и после реакции. Например, в реакции, протекающей по схеме
KMn+7O4 + Na2S+4O4 + H2SO4 ¾®
¾® Mn+2SO4 + Na2S+6O4 + K2SO4 + H2O
изменяют степень окисления только марганец и сера.
2. Составить электронные уравнения процессов окисления и восстановления:
Mn+7 + 5 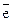 ¾® Mn+2 окислитель (восстановление) (1)
¾® Mn+2 окислитель (восстановление) (1)
S+4 - 2 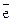 ¾® S+6 восстановитель (окисление) (2)
¾® S+6 восстановитель (окисление) (2)
 3. Найти наименьшее общее кратное (НОК) для числа принятых (уравнение 1) и отданных (уравнение 2) электронов и с его помощью расставить множители для обоих уравнений: НОК для 5 и 2 равно 10, множитель для уравнения (1) - 10: 5 = 2, множитель для уравнения (2) - 10: 2 = 5.
3. Найти наименьшее общее кратное (НОК) для числа принятых (уравнение 1) и отданных (уравнение 2) электронов и с его помощью расставить множители для обоих уравнений: НОК для 5 и 2 равно 10, множитель для уравнения (1) - 10: 5 = 2, множитель для уравнения (2) - 10: 2 = 5.
Mn+7 + 5 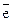 ¾® Mn+2 2
¾® Mn+2 2
 S+4 - 2
S+4 - 2 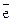 ¾® S+6 5
¾® S+6 5
2 Mn+7 + 5 S+4 ¾® 2 Mn+2 + 5 S+6
Такая процедура получила название «составление электронного баланса».
4. Найденные коэффициенты подставить в уравнение реакции:
2KMnO4 + 5Na2SO3 + H2SO4 ® 2MnSO4 + 5Na2SO4 + K2SO4 + H2O
5. Подобрать остальные коэффициенты в следующем порядке:
- перед соединениями, содержащими атомы металлов (в данном примере 1 перед K2SO4);
- перед формулой вещества, создающего среду в растворе (в нашем случае перед формулой H2SO4 необходим коэффициент 3, так как на связывание ионов Mn+2 и К+ идёт три моля кислоты);
- перед формулой воды - по числу атомов водорода (3).
6. Проверить правильность расстановки коэффициентов, подсчитав суммарное число атомов каждого элемента в левой и правой частях уравнения. Нередко ограничиваются подсчётом числа атомов кислорода в исходных веществах и продуктах реакции. Окончательный вид уравнения:
2KMnO4 + 5Na2SO3 + 3H2SO4 ═ 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Окислительно-восстановительные реакции подразделяются из три типа:
1. Межмолекулярные окислительно-восстановительные реакции. В таких реакциях обмен электронами происходит между различными молекулами разных веществ. К этому типу относятся выше приведённая реакция, а также следующий пример: +2 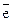
 |


 Cu+2SO4 + Zn0 ═ Zn+2SO4 + Cu0
Cu+2SO4 + Zn0 ═ Zn+2SO4 + Cu0
-2 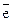
2. Внутримолекулярные окислительно-восстановительные реакции. В таких реакциях окислитель и восстановитель входят в состав одного вещества. Например:
+6 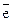
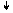



 2KCl+5O-23 ═ 2KCl-1 + 3O02
2KCl+5O-23 ═ 2KCl-1 + 3O02

 -2
-2 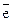
 |
3. Реакции диспропорционирования (реакции самоокисления-самовосстановления). В таких реакциях молекулы одного и того же вещества взаимодействуют друг с другом как окислитель и восстановитель. Диспропорционированию подвергаются подвергаются вещества, содержащие атомы в промежуточной степени окисления, например: +2 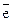
 |
3K2Mn+6O4 + 2H2O ═ 2KMn+7O4 + Mn+4O2 + 4KOH

 -1
-1 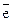
 |
Date: 2015-05-04; view: 800; Нарушение авторских прав