
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические основы. При контакте поверхности металла с водным раствором соли определённая часть катионов металла под действием полярных молекул воды в гидратированном виде
|
|
При контакте поверхности металла с водным раствором соли определённая часть катионов металла под действием полярных молекул воды в гидратированном виде переходит из металлической фазы в раствор. На границе раздела фаз «металл ─ раствор» устанавливается динамическое равновесие:
Me + mH2O = Men+·mH2O + n 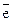
атом металла гидратированный
катион металла
При этом металл заряжается отрицательно, если преобладал процесс перехода ионов металла в раствор, или положительно, если преобладал процесс осаждения этих ионов на поверхности металла. Металлический проводник, погружённый в раствор электролита, называется электродом. Разность потенциалов, которая возникает на границе между металлом и водным раствором в состоянии равновесия, называется равновесным электродным потенциалом.
Абсолютные значения электродных потенциалов измерить нельзя. Обычно определяют относительные потенциалы металлов, принимая условно за нуль значение потенциала водородного электрода. Разность потенциалов между металлом, погружённым в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом, называется стандартным (или нормальным) электродным потенциалом металла (jо).
Если расположить металлы в порядке возрастания их стандартных электродных потенциалов, то получим ряд напряжений металлов. Положение металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Из ряда напряжений металлов (приложение 3) вытекают следствия:
1. Каждый предыдущий металл в ряду напряжений вытесняет расположенный за ним металл из растворов солей.
2. Только металлы с отрицательными значениями потенциалов способны вытеснять водород из его соединений.
3. Чем левее (раньше) в ряду напряжений находится металл, тем легче он отдаёт электроны (электрохимически активнее) и тем труднее восстанавливаются его ионы до атомов.
4. В гальваническом элементе анодом служит тот металл, который в ряду напряжений характеризуется наиболее отрицательным потенциалом, т.е. более активный металл.
Величина электродного потенциала зависит от природы металла, температуры и концентрации раствора электролита. Эта зависимость выражается уравнением Нернста:
j = jо + 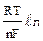 С, где
С, где
j - электродный потенциал металла, В;
jо - стандартный электродный потенциал металла, В;
R - универсальная газовая постоянная, равная 8.31 Дж/(моль·К);
Т - температура в градусах абсолютной шкалы;
n - валентность иона металла;
F - число Фарадея, равное 96500 Кл/моль;
С - концентрация ионов металла в растворе, моль/л.
При подстановке в формулу Нернста всех констант и стандартной температуры (298 К) она приобретает вид:
j = jо + 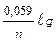 С.
С.
При С = 1 моль/л равновесный потенциал становится равным стандартному: j = jо. Формулу Нернста можно применять только к металлам, погружённым в растворы своих солей.
Гальваническим элементом (ГЭ) называется устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. Гальванический элемент представляет собой систему из двух электродов, растворы электролитов которых сообщаются. На границах металлов и растворов устанавливаются разные электродные потенциалы. При замыкании цепи электроны перемещаются по внешнему её участку от электрода с меньшим потенциалом к электроду с большим потенциалом. На первом электроде идёт процесс окисления:
Мео1 - n 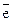 = Men+1.
= Men+1.
Этот электрод, который в процессе работы ГЭ окисляется и посылает электроны во внешнюю цепь, называется анодом.
На втором электроде, называемом катодом, происходит восстановление катионов, присутствующих в растворе электролита:
Меn+2 - n 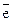 = Meо2.
= Meо2.
Металл Me2 осаждается на катоде. Анод в гальванических элементах имеет знак минус, катод - плюс.
Электродвижущая сила (ЭДС, или Е) рассчитывают по формуле:
ЭДС = j К - jА, где
jК и jА - электродные потенциалы катода и анода, соответственно.
Пример. Рассмотрим работу гальванического элемента, составленного из медного и цинкового электродов, погруженных в раствор соответствующих сульфатов с концентрациями:
С(CuSO4) = 0.01 моль/л и С(ZnSO4) = 0.1 моль/л.
Решение. Краткая схема данного гальванического элемента: 



(-) Zn ZnSO4, 0.1 M CuSO4, 0.01 M Cu (+)
Вертикальная часть обозначает поверхность раздела между металлом и раствором, а две черты - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита, которую называют солевым мостиком). Значения стандартных электродных потенциалов меди и цинка:
jоСu = + 0.34 B, jоZn = - 0.76 B (см. приложение 3).
Следовательно, цинковый электрод в данном ГЭ является анодом, а медный - катодом. Цинк отдаёт электроны, то есть окисляется и его ионы переходят в раствор. На катоде происходит восстановление ионов меди. Уравнения электродных процессов:
А) Znо - 2 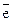 = Zn2+ К) Cu2+ + 2
= Zn2+ К) Cu2+ + 2 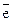 = Cuо
= Cuо
Суммарное уравнение реакции, которое служит источником электрической энергии в медно-цинковом гальваническом элементе, имеет вид: Zn + CuSO4 ¾® Cu + ZnSO4
Подобного рода источники тока называются гальваническими элементами Якоби-Даниэля. Полная схема рассматриваемого ГЭ записывается следующим образом:






















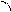







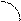










 е-
е-
V А) Zno - 2e- ® Zn2+
 K) Cu2+ + 2e- ® Cuo
K) Cu2+ + 2e- ® Cuo
A- SO42- K+ Zno + CuSO 4 ® Cu+ ZnSO 4
Zn Cu
 |  |
раствор ZnSO 4 раствор CuSO 4
Для определения электродвижущей силы вычислим сначала электродные потенциалы меди и цинка по уравнению Нернста:
jСu = jоСu +  = 0.34 + (-0.059)» 0.28 В.
= 0.34 + (-0.059)» 0.28 В.
jZn = jоZn + 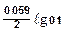 = - 0.76 + (-0.0295)» - 0.79 В.
= - 0.76 + (-0.0295)» - 0.79 В.
Электродвижущая сила: ЭДС = jСu - jZn = 0.28 - (-0.79) = 1.07 В.
Date: 2015-05-04; view: 752; Нарушение авторских прав