
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

S 3p 3d
|
|
Характер застройки энергетических подуровней определяет принадлежность элемента к тому или иному электронному семейству:
s -элементы - застройка внешнего s -подуровня, например:
Калий К 1s22s22p63s23p64s1
р -элементы - застройка внешнего р -подуровня, например:
Фосфор Р 1s22s22p63s23p3
d -элементы - застройка предвнешнего d -подуровня, например:
Ванадий V 1s22s22p63s23p63d34s2
f -элементы - застройка третьего снаружи f -подуровня, например:
Церий Се 1s22s22p63s23p63d104s24p64d104f25s25p65d06s2
Естественной классификацией элементов по электронным конфигурациям их атомов является периодическая система элементов Менделеева. Причина периодичности свойств элементов заключается в периодической повторяемости сходных электронных конфигураций.
В периодах (горизонтальных строках таблицы) свойства элементов изменяются в связи с закономерным изменением электронных структур их атомов.
В группах (вертикальных строках таблицы) свойства элементов сходны благодаря аналогии в электронном строении внешнего валентного уровня.
Номер периода определяет номер внешнего энергетического уровня в электронных формулах элементов. Количество элементов в каждом периоде соответствует минимальной ёмкости застраивающихся энергетических подуровней.
Номер группы отвечает числу валентных электронов в атоме элемента. Кроме первого, каждый период начинается с двух s -элементов и заканчивается шестью р -элементами. В больших периодах между этими семействами располагаются десять d- элементов (4....6 периоды). В 6 периоде к ним добавляется четырнадцать f- элементов, 7 период не завершён.
Указанные закономерности позволяют составить электронную формулу элемента. Например, элемент тантал находится в 6 периоде, V группе, побочной подгруппе. Это говорит о том, что в атоме этого элемента шесть энергетических уровней, пять валентных электронов. Перед танталом в 6 периоде стоят два s -элемента и два d -элемента. Сам тантал - третий по счёту d -элемент. Следовательно, его валентные электроны имеют конфигурацию 5d36s2. Предыдущие энергетические уровни застроены полностью. Полная электронная формула этого элемента имеет вид:
Та 1s22s22p63s23p63d104s24p64d104f145s25p65d36s2.
В периодической зависимости от зарядов ядер атомов находится валентность (степень окисления), атомные и ионные радиусы, энергия ионизации, энергия сродства к электрону, электроотрицательность и другие свойства.
В простейшей трактовке валентности как степени окисления атомов её отождествляют с числом электронов, отдаваемых или приобретаемых атомами в процессе взаимодействия.
Высшую степень окисления атом приобретает, отдав все свои валентные электроны, поэтому её величина соответствует номеру группы, в которой находится данный элемент. Так, высшая степень окисления азота - +5 (V группа элементов), серы - +6 (VI группа элементов).
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении электронов, необходимых ему для приобретения устойчивой восьмиэлектронной оболочки (октета электронов). Отсюда низшую степень окисления можно рассчитать по разности между 8 и номером группы. Например, для азота низшая степень окисления равна -3, для серы -2. Следует учесть, что металлы не проявляют отрицательных степеней окисления, для них минимальным значением этой величины является 0.
Значение высшей и низшей степеней окисления атомов элементов позволяет составлять формулы их соединений: высших оксидов, гидроксидов, солей, водородных соединений. При составлении формул следует учитывать требование электронейтральности. Степени окисления кислорода, как правило, -2, водорода - +1.
Общая формула оксидов - соединений элемента с кислородом - Э+mxО-2y, водородных соединений - Э-mН+1m, гидроксидов - оснований Э+m(ОН)m. Простейшие формулы кислородсодержащих кислот выражаются общими формулами: НЭ+7О4, Н2Э+6О4,
Н3Э+5О4 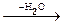 НЭ+5О3, Н4Э+4О4
НЭ+5О3, Н4Э+4О4 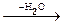 Н2Э+4О3
Н2Э+4О3
орто мета орто мета
Энергия ионизации, энергия сродства к электрону, электроотрицательность являются мерами проявления элементами металлических и неметаллических свойств. Металлические (восстановительные) свойства определяются способностью атомов элементов к отдаче электронов, неметаллические (окислительные) - тенденцией к присоединению электронов.
Металлические свойства наиболее характерны для элементов, в атомах которых на внешнем энергетическом уровне находится небольшое количество электронов: от одного до трёх. Неметаллические свойства, в первую очередь, проявляют элементы, в атомах которых на внешнем уровне от четырёх до семи электронов.
В периоде периодической системы металлические свойства элементов убывают с ростом порядкового номера; неметаллические свойства, напротив, возрастают в том же направлении. Это связано с закономерным ростом числа валентных электронов.
В группе металлические свойства возрастают с ростом порядкового номера, а неметаллические убывают, что связано с увеличением радиуса атома с ростом порядкового номера элемента, удалённостью внешних электронов от ядра и ослаблением сил притяжения между электронами и ядром.
Большинство элементов периодической системы проявляют как металлические, так и неметаллические свойства. Вклад тех или других определяется спецификой электронной структуры атома. Количественно этот вклад можно охарактеризовать с помощью величины электроотрицательности атома, представляющей собой полусумму энергии ионизации и энергии сродства к электрону. Электроотрицательность возрастает в периоде с ростом порядкового номера и убывает в группе с ростом порядкового номера.
Свойства соединений элементов можно рассматривать с двух точек зрения: как кислотно-основные и окислительно-восстановительные. Типичные металлы образуют оксиды и гидроксиды основного характера, типичные неметаллы - кислотные оксиды и кислоты. Кислотно-основной характер остальных элементов, в первую очередь, это относится к d -элементам, зависит от степени окисления их атомов: с ростом степени окисления основной характер соединений сменяется амфотерным и далее переходит в кислотный. Например, хром в степени окисления +2 образует оксид CrO и гидроксид Cr(OH)2, проявляющие основные свойства. Соединения хрома +3 - Cr2O3, Cr(OH)3 -амфотерны, а оксид и гидроксид хрома в степени окисления +6 носят кислотный характер (CrO3, Н2СrO4 и H2Cr2O7).
Date: 2015-05-04; view: 772; Нарушение авторских прав