
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические основы. Многие химические реакции протекают в растворах
|
|
Многие химические реакции протекают в растворах. В истинных растворах растворённое вещество диспергировано до его мельчайших частиц (молекул, ионов или атомов). Истинными растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов.
Состав раствора выражают концентрацией растворённых веществ. Основными способами выражения концентрации являются:
 |
1.Массовая доля растворённого вещества (wв) – это количество весовых частей растворённого вещества, содержащегося в ста весовых частях раствора (выражается в %):
где mр – масса раствора (например, в граммах), mА – масса растворителя (г), mв – масса растворенного вещества (г).
2. Молярность, или молярная концентрация (С) – это количество вещества (nв, моль) растворённого вещества, содержащееся в 1 литре раствора (выражается в моль/л º М):
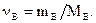
 |
где Mв – молярная масса растворённого вещества (г/моль), V – объём раствора в литрах, r - плотность раствора (г/мл), причём количество вещества растворённого вещества:
3. Моляльность, или моляльная концентрация (Сm) – это количество вещества (nв, моль) растворённого вещества, приходящееся на 1 кг растворителя (выражается в моль/кг):
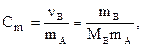
где mА – масса растворителя (кг).
4. Мольная доля растворённого вещества (cв) – это отношение количества вещества растворённого вещества к сумме количества вещества всех веществ в растворе:

где nА – количество вещества растворителя (моль), MА – молярная масса растворителя (г/моль).
Очень разбавленные растворы (с низкой концентрацией растворенного вещества) по своим свойствам приближаются к идеальным растворам. В идеальных растворах каждый компонент ведёт себя независимо от других компонентов. В таких растворах силы межмолекулярного взаимодействия между компонентами одинаковы. Коллигативные (общие, или коллективные) свойства идеальных растворов зависят от концентрации и практически не зависят от природы растворённых веществ. К ним, в частности, относятся повышение температуры кипения и понижение температуры замерзания растворов и осмотическое давление.
Температура кипения растворов выше температуры кипения растворителей. Согласно закону Рауля повышение температуры кипения DТкип пропорционально моляльности раствора и не зависит от природы растворенного вещества
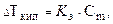
где К э - эбулиоскопическая постоянная растворителя.
Температура замерзания (кристаллизации) растворов ниже температуры замерзания (кристаллизации) чистых растворителей. Согласно закону Рауля понижение температуры замерзания DТзам пропорционально моляльности раствора и не зависит от природы растворенного вещества
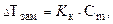
где К к - криоскопическая постоянная растворителя.
Значения К э и К к (измеряются в кг×К/моль) зависят от природы растворителей. Например, для воды: К э = 0,52 и К к = 1,86; для этанола: К э = 1,22 и К к = 1,99.
Используя уравнения закона Рауля можно определить молярную массу растворенного вещества. Для этого экспериментально находят DТкип и DТзам. Зная массу растворенного вещества mв и растворителя mА, рассчитывают молекулярную массу растворенного вещества Mв по уравнению
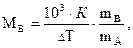
где К º К э или К º К к.
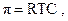 Если раствор и растворитель разделены полупроницаемой мембраной, то возможен самопроизвольный переход молекул растворителя из растворителя в раствор. Односторонняя диффузия частиц через пористую перегородку получила название «осмос». Раствор при этом разбавляется, и высота его столба увеличивается. Количественно осмос характеризуется осмотическим давлением p, которое равно давлению столба раствора в осмометре высотой h. Согласно закону Вант-Гоффа осмотическое давление относительно чистого растворителя пропорционально молярной концентрации раствора где R = 8,314 Дж/К×моль –
Если раствор и растворитель разделены полупроницаемой мембраной, то возможен самопроизвольный переход молекул растворителя из растворителя в раствор. Односторонняя диффузия частиц через пористую перегородку получила название «осмос». Раствор при этом разбавляется, и высота его столба увеличивается. Количественно осмос характеризуется осмотическим давлением p, которое равно давлению столба раствора в осмометре высотой h. Согласно закону Вант-Гоффа осмотическое давление относительно чистого растворителя пропорционально молярной концентрации раствора где R = 8,314 Дж/К×моль –
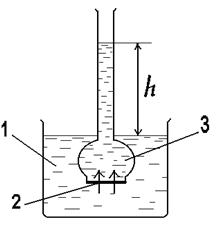
Рис.5. Схема осмометра: 1 - вода; 2 - раствор; 3-полупроницаемая мембрана.
универсальная газовая постоянная, Т – абсолютная температура, С – молярная концентрация раствора.
Осмос играет важную роль в биологических процессах, обеспечивая поступление воды. Растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
Пример. Приготовлен раствор с плотностью r = 1,01 г/мл из 1,5 г глутаминовой кислоты (Mв = 147 г/моль) и 100 г воды (MА = 18 г/моль). Рассчитать массовую и мольную доли глутаминовой кислоты в растворе, молярную и моляльную концентрации раствора, повышение температуры кипения и понижение температуры замерзания, а также величину осмотического давления, если мембрана пропускает только молекулы воды и температура опыта 25°С. Постоянные воды: К э = 0,52 и К к = 1,86.
Массовая доля:

Мольная доля:
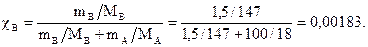
Моляльность:
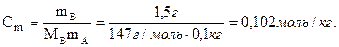
Молярность:
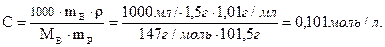
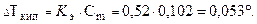 Повышение температуры кипения:
Повышение температуры кипения:
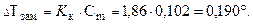 Понижение температуры замерзания:
Понижение температуры замерзания:
Осмотическое давление:
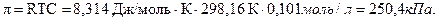
Date: 2015-05-04; view: 693; Нарушение авторских прав