
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

S 3p 3d. Отсюда получаем следующую электронную схему молекулы хлора Сl2 : : + : ¾® : : : или Сl¾Cl
|
|
Отсюда получаем следующую электронную схему молекулы хлора Сl2 :: 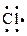 +:
+: 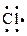 ¾®:
¾®: 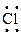 :
: 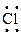 : или Сl¾Cl
: или Сl¾Cl
Ковалентную связь, образованную посредством одной общей электронной пары, называют ординарной и изображают в структурных формулах одним валентным штрихом. Если же связь образуется за счёт двух или трёх общих электронных пар, она называется двойной или тройной, соответственно.
Кратные ковалентные связи изображают в структурных формулах двумя или тремя валентными штрихами. Так, атом азота имеет три неспаренных электрона:
 |  |
N ¯
S 2p
поэтому молекула N2 образуется в результате обобщения трёх электронных пар (возникает тройная ковалентная связь):
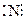 +
+ 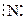 ¾®
¾® 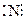
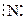 или N ≡ N
или N ≡ N
В молекуле оксида углерода (IV) двойные ковалентные связи:
: 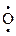 : + ∙
: + ∙ 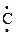 ∙+:
∙+: 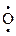 : ¾®
: ¾®  ::
:: 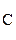 ::
:: 
или О=С=О
Молекула СО2 образована атомом углерода в возбуждённом состоянии: С* 2s12p3.
Таким образом, валентность химического элемента (как способность его атомов образовывать определённое число химических связей) зависит от количества неспаренных электронов его атома в основном или возбуждённом состояниях.
Одним из свойств ковалентной химической связи является её полярность. Если электроотрицательность (способность к смещению электронной плотности) атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается строго симметрично по отношению к обоим ядрам. Такая ковалентная связь называется неполярной. Неполярная ковалентная связь осуществляется, например, в молекулах Н2, F2, O2, N2, в любых других гомоядерных молекулах, образованных атомами одного и того же элемента.
Если же электроотрицательность атомов различна, электронная пара смещается в сторону более электроотрицательного атома. При этом возникают частичные (дробные) заряды: отрицательный на более электроотрицательном атоме и положительный на атоме с меньшей электроотрицательностью. В молекуле образуются два полюса. Подобные ковалентные связи называют полярными. Например, в молекулах НCl, H2O, NH3 и т.д.
В случае очень большой разницы в электроотрицательностях (численно более 2), поляризация связи приобретает необратимый характер. Это происходит тогда, когда соединение образуют, с одной стороны, атом, легко отдающий свои валентные электроны, имеющий низкий потенциал ионизации (прежде всего, это щелочные и щёлочно-земельные металлы), а с другой стороны, атом, проявляющий тенденцию к присоединению электронов, обладающий высоким сродством к электрону (галогены, кислород, азот и, отчасти, сера и фосфор). При этом электрон полностью переходит от первого атома ко второму. Атомы превращаются в заряженные частицы - ионы. Атом, отдавший один электрон, приобретает заряд +1 и называется катионом. Атом, приобретший дополнительный электрон, получает заряд -1 и называется анионом. Электростатическое притяжение, возникшее между разноименно заряженными ионами, называют ионной химической связью. Примерами ионных соединений являются галогениды и оксиды щелочных металлов: LiCl, K2O, CsI и т.п.
Повышение электронной плотности в результате образования общей электронной пары (ковалентная химическая связь) можно представить с помощью области перекрывания атомных орбиталей, занятых неспаренными валентными электронами, образующих данную молекулу. Перекрывание орбиталей происходит в том направлении, которое обеспечивает образование максимальной области перекрывания. По этой причине, а также в связи с тем, что орбитали имеют определённую геометрическую форму, ковалентная связь обладает свойством направленности.
Перекрывание орбиталей может осуществляться разными способами. Например, при образовании s-связи перекрывание происходит
вдоль линии, соединяющей ядра (рис. 1):
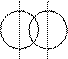 | |||||
 | |||||
 | |||||



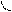
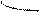
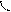
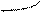



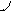
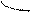
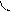



 |  |
s s s p p p
(молекула Н2) (молекула НCl) (молекула Сl2)
Рис. 1. Перекрывание орбиталей s-способом.
При боковом перекрывании орбиталей образуется p-связь. В этом случае возникают две общие области: над и под плоскостью, в которой лежат ядра. На схемах p-связь принято изображать условно (рис. 2, а и б).

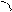

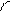
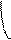
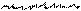
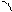

 а) б)
а) б)
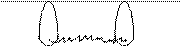 | |||
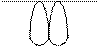 | |||
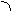
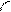
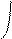
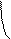

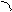
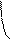
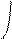
Рис.2. Перекрывание орбиталей p-способом.
s- и p-Способами перекрывания орбиталей характеризу-ется не ионная, а ковалентная связь. Причём, s-способ приводит к образованию более прочной ковалентной связи, поскольку в этом случае реализуется большая степень перекрывания.
Для того чтобы дать характеристику определённой молекулы методом ВС, требуется:
- по величинам электроотрицательности определить тип химической связи (ковалентная неполярная, ковалентная полярная или ионная) в соединении;
- написать электронные формулы атомов, принимающих участие в образовании молекулы;
- выбрать валентные электроны; распределить их по квантовым ячейкам; выбрать неспаренные электроны;
- в случае, если количество неспаренных электронов меньше численного значения валентности многовалентного атома, перевести последний в возбуждённое состояние;
- установить, на каких орбиталях находятся эти неспаренные электроны;
- если связь ковалентная, нарисовать перекрывание этих орбиталей в молекуле;
- если связь ионная, указать, какие атомы и сколько электронов отдают и принимают, указать величину зарядов ионов в соединении.
Пример: молекула сероводорода (H2S).
Электроотрицательность: серы 2.58, водорода 2.10. Связь между атомами Н и S - ковалентная полярная. Обобществленные электронные пары смещены в молекуле сероводорода от атомов водорода (на которых появляется частичный положительный заряд) к атому серы (возникает частичный отрицательный заряд). Электронная формула водорода: Н 1s1; серы: S 1s22s22p63s23p4. Валентные электроны водорода: 1s1; серы: 3s23p4. Распределение электронов по квантовым ячейкам:





Н S ¯ ¯
1s 3s 3p
Неспаренные электроны серы занимают две 3р-орбитали. Поскольку спиновая валентность атома серы соответствует валентности, обусловливающей формульный состав молекулы сероводорода, атом серы образует две химические связи в основном состоянии.
По причине взаимной перпендикулярности двух р-орбиталей одного подуровня, схема перекрывания 3р-орбиталей серы и s-орбиталей двух атомов водорода имеет вид, представленный на рис. 3,а. Соединив ядра атомов водорода и серы прямыми линиями, получаем геометрическую фигуру, дающую представление о форме молекулы: молекула сероводорода имеет угловое строение (рис. 3,б).
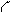





 а) S б) S
а) S б) S
 |


 H H
H H 

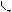
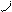
i i
Рис.3. Угловое строение молекулы сероводорода:
а) схема перекрывания орбиталей;
б) форма молекулы.
В возбуждённых состояниях некоторых многовалентных атомов неспаренные электроны занимают разные энергетические уровни, то есть характеризуются орбиталями различной формы и энергии. Однако согласно экспериментальным данным, химические связи, образуются такими атомами, эквивалентны (равноценны). В подобных случаях прибегают к представлениям о гибридизации орбиталей. Этот процесс заключается в том, что из разных по форме и энергии орбиталей образуются одинаковые, так называемые гибридные  орбитали. При этом тип гибридизации обусловливает определённую форму молекулы.
орбитали. При этом тип гибридизации обусловливает определённую форму молекулы.
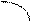
Типы гибридизации для s- и р-орбиталей приведены в табл. 2.
Т а б л и ц а 2
| Исходные орбитали | Тип гибри- дизации | Геометрия молекулы |
            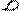 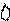 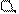   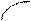 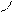 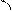 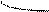 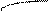 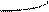    Одна s и
одна р
Одна s и
две р
Одна s и
три р Одна s и
одна р
Одна s и
две р
Одна s и
три р
| sp sp2 sp3 | 180°
Линейная
Тригональная 120°
(плоскотреу-
гольная)
 109° 28¢
Тетраэдри-
ческая
109° 28¢
Тетраэдри-
ческая
|
Пример: молекула тетрабромметана (СBr4).
Электронные формулы: С 1s22s22p2
Br 1s22s22p63s23p63d104s24p5.
Валентные электроны: С 2s22p2; Br 4s24p5.
Распределение по квантовым ячейкам (основное состояние):
 |  |  |  |
С ¯ Br ¯ ¯ ¯
2s 2p 4s 4p



 Поскольку валентность углерода в CBr 4 равна 4, атом углерода вступает во взаимодействие с атомом брома не в основном, а в возбуждённом состоянии:
Поскольку валентность углерода в CBr 4 равна 4, атом углерода вступает во взаимодействие с атомом брома не в основном, а в возбуждённом состоянии:
С *
Из одной s- и трёх р-орбиталей 2s 2p
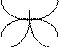
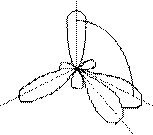
атома углерода (по числу исходных) образуются четыре гибридных sp 3 -орбитали. Такому типу гибридизации соот-ветствует тетраэдрическая форма молекулы четырёх-бромистого углерода (рис.4):
 Br
Br

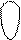 |  | ||
109° 28¢
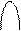 |


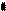

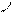
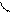
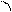
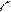 С
С
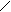


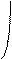
 . Br
. Br

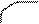
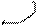


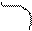


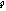











 Br
Br
Br
Рис.4. Перекрывание орбиталей в молекуле СBr4 и
геометрия этой молекулы.
Date: 2015-05-04; view: 902; Нарушение авторских прав