
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические основы. Химическая связь возникает при взаимодействии атомов и приводит к образованию многоатомной системы - молекулы
|
|
Химическая связь возникает при взаимодействии атомов и приводит к образованию многоатомной системы - молекулы, молекулярного иона, кристалла. Причиной (движущей силой) возникновения химической связи является уменьшение потенциальной энергии при переходе от изолированных атомов к устойчивой многоатомной системе.
Мерой прочности химической связи является её энергия, величина которой определяется количеством энергии, выделившейся при образовании вещества из отдельных атомов. Например, энергия связи Н¾Н в молекуле водорода равна 435 кДж/моль. Это значит, что при образовании 1 моля газообразного водорода по уравнению
Н + Н = Н2 + 435 кДж/моль
выделяется 435 кДж теплоты. Такое же количество энергии должно быть затрачено на распад 1 моля Н2 до атомарного состояния (энергия диссоциации).
Химическая связь характеризуется также длиной, под которой понимают расстояние между ядрами химически связанных атомов. Так, длина химической связи Н¾О в молекуле воды Н2О равна 0.096 нм (1 нм = 1· 10-9 м).
Химическая связь возникает благодаря взаимодействию электромагнитных полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
Современная теория химической связи базируется на квантово-механической модели строения атома. В ней можно выделить два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
В основе метода МО лежат представления об орбитальном строении молекул. Задачей этого метода является характеристика энергетических параметров электронов в молекуле, выходными данными в таком случае является энергетическая диаграмма соответствующих уровней.
Охарактеризовать молекулу методам ВС - это означает представить графически распределение электронной плотности в молекуле. Ниже кратко излагаются основные представления этого метода в применении к ковалентной химической связи.
Ковалентная химическая связь образуется парой электронов с противоположно направленными спинами, для чего каждый атом предоставляет один неспаренный электрон, называемый валентным. Эта пара электронов принадлежит одновременно обоим взаимодействующим атомам, что означает повышение электронной плотности в пространстве между ядрами (центрами) химически связанных атомов. Поэтому ковалентная химическая связь является двухэлектронной и двухцентровой. Процесс «спаривания» электронов при образовании, например, молекулы водорода может быть изображён следующей схемой:
 Н
Н
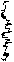
¾® Н2
 | |||
 | |||
Н ¯ ¯
По Льюису указанный механизм наглядно представляют в виде электронной схемы молекулы, где электрон изображают точками. Для молекулы водорода такая схема имеет вид:
Н· + ·Н ¾® Н: Н
В графической формуле молекул пара точек заменяется валентным штрихом, соответствующим одной химической связи: Н¾Н.
Атом хлора имеет на наружном уровне 7 электронов:
Cl 3s23p5, из которых один является неспаренным:








 Cl ¯ ¯ ¯
Cl ¯ ¯ ¯
Date: 2015-05-04; view: 636; Нарушение авторских прав