
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

VI. Рефлексивно- диагностический этап (5 мин)
|
|
На этом этапе учитель организует беседу по достигнутым результатам, с помощью обсуждения ответов учащихся на вопросы по теме:
«Кислородсодержащие соединения серы. Оксид серы(IV), оксид серы(VI), серная кислота». Получает информацию о проблемных зонах для последующей коррекции знаний и умений учащихся. Предлагает домашнее задание на выбор
| Деятельность учителя | Деятельность учащихся |
| Организует деятельность учащихся по осмыслению знаний и умений по новой теме, успешности достижения целей урока, предлагая вопросы по теме: «Кислородсодержащие соединения серы. Оксид серы(IV), оксид серы(VI), серная кислота». Сообщает об элементах знаний, не усвоенных большинством учащихся. Подводит итоги урока, дает качественную оценку работы класса и отдельных учащихся. Выставляет отметки. Предлагает домашнее задание на выбор (исходя из эффективности урока) | В ходе беседы с учителем осмысливают собственные знания и приобретенные умения, выявляют не усвоенные элементы знаний, сопереживают успехи учащихся класса, оценивают собственные результаты. Записывают домашнее задание, выбранного уровня |
Приложение 1.
Самостоятельная работа «Кислород и сера»
1. В перечне веществ – P4, S8, O3, Sn, O2 – подчеркните формулу:
а) озона; в) серы пластической;
б) серы ромбической; г) кислорода.
2. Определите степени окисления атомов в соединениях:
а) OF2, O2, Al2O3; б) S8, SF6, H2SO3;
б) H2S, SO2, H2SO4; г) K2SO3, Na2S, SO3.
3. Из предложенного ряда схем перехода электронов:
S-2 – 6e = S+4, S0 +2e = S-2,
O02 + 4e = 2O-2, 2O – 4e = O0
выпишите схему процесса:
а) окисления серы ______________________________________________________;
б) восстановления кислорода _____________________________________________;
в) восстановления серы __________________________________________________;
г) окисления кислорода __________________________________________________.
4. Составьте уравнения реакций согласно схеме:
  а) S а) S 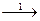 H 2S SO2 H 2S SO2
|
б) H2O 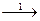 O2 Al2O3 O2 Al2O3
|
 в) ZnS в) ZnS 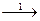 S S O2 S S O2
|
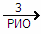 г) O3 г) O3  O2 NO O2 NO
|
5. Исходя из электронной конфигурации внешнего электронного слоя атома серы, обоснуйте и поясните примерами:
а) возможные степени окисления атомов серы в соединениях;
б) в каких процессах – окисления и (или) восстановления – могут принимать участие атомы серы;
в) ослабление окислительных свойств и возрастание восстановительных свойств серы, по сравнению с кислородом;
г) валентные состояния и степени окисления атомов серы в веществах: S2 (парообразная сера) и S8 (сера ромбическая).
Приложение 2.
Самостоятельная работа № 25 «Водородные соединения кислорода и серы»
1. Укажите правильные («+») и неправильные («—») утверждения:
а) молекула воды имеет угловое строение; угол связи Н—О—Нсоставляет 104,5°;
б) сероводородная кислота является сильной кислотой;
в) молекула сероводорода имеет угловое строение; угол связи Н—S—Н равен 92°;
г) плотность твердой воды (льда) больше, чем жидкой воды.
2. Опишите физические свойства:
а) сероводорода;
б) воды;
в) пероксида водорода;
г)сероводородной кислоты.
3. Запишите уравнение реакции согласно схеме:

4. Составьтеуравнения реакций согласно схеме:

5. Обоснуйте:
а) аномально высокие температуры плавления и кипения воды;
б) проявление у воды окислительных и восстановительных свойств;
в) проявление у сероводорода окислительных и восстановительных свойств;
г) окислительно-восстановительную двойственность пероксида водорода.
Приложение 3.
Кислородсодержащие соединения серы
1. Заполните таблицу «Свойства оксидов серы»
| Свойства | Оксид серы (IV)SО2 | Оксид серы (VI)SО3 |
| 1.Агрегатное состояние при обычных условиях | ||
| 2. Цвет | ||
| 3. Запах | ||
| 4. Растворимость в воде | ||
| 5. Отношение к кислороду | ||
| 6. Отношение к щелочам | ||
| 7. Отношение к основным и амфотерным оксидам | ||
| 8. Окислительная и/или восстановительная способность |
2. Ознакомьтесь со схемой, характеризующей химические свойства разбавленного раствора серной кислоты.

3. Напишите уравнения реакций согласно схеме (по вариантам).
Приложение 4.
Date: 2015-11-15; view: 850; Нарушение авторских прав