
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ле Шателье принципі.Тепе-теңдікке әсер ететін факторлар
|
|
Әрекеттесуші заттардың концентрациясы, температурасы және қысымы (газ күйіндегі реакцияға) өзгергенде химиялық тепе-теңдіктің ығысу бағыты жылжымалы тепе-теңдік принципі немесе Ле Шателье принципі деп аталатын жалпы ережемен анықталады:
Тепе-тецдік куйдегі ситемаға сырттан әсер етсе (концентрация, температура, қысым өзгерсе), онда қарама-қарсы екі реакцияның ішінен сол әсерді азайтатынының жүруіне көмектеседі.
Мұны аммиакты синтездеу реакциясын мысалға ала отырып көрсетейік

Тепе-теңдікке концентрацияның әсері. Егер сыртқы әсер сутегі немесе азот концентрациясын жоғарылатса, онда ол сол заттардың концентрациясын төмендететін реакцияның жүруіне көмек етеді, демек тепе-теңдік аммиактың түзілу бағытына қарай ығысады. Сол сияқты аммиактың концентрациясы көбейсе, онда тепе-теңдік алғашқы заттардыд бағытына қарай ығысады.
Тепе-теңдікке температураның әсері. Теңдеуден көрініп тұрғандай, тура реакция жүргенде жылу бөлінетіндіктен коспаның температурасы артқан сайын жылу сіқіре жүретін реакцияға жағдай туады да тепе-теңдік бастапқы заттар бағытына қарай ығысады; температураны төмендетсе тепе-теңдік реакция өнімдері бағытына қарай ығысады.
Тепе-теңдікке қысымның әсері. Тепе-теңдікке қысымның әсерін байқау үшін теңдеудің сол және оң жағындағы заттардың молекула санын есептеу керек.
Келтірілген мысалда теңдеудің сол жағында 2 молекула, ал оң жағында 1 молекула бар. Қысым артқанда молекулалар санының кемуіне әкелетін процесс жүретіндіктен бұл жағдайда тепе-теңдік реакция өнімінің бағытына қарай ығысады. Демек, егер қысым азайса тепе-теңдік бастапқы заттар бағытына қарай ығысады.
Қайтымды реакция теңдеуінің оң және сол жағындағы молекулалар саны тең болса, мысалы
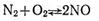
онда қысымның өзгеруі химиялық тепе-теңдіктің ығысуын туғызбайды.
Барлық катализаторлар тура және кері реакцияны бірдей шапшаңдатады, сондықтан тепе-теңдіктің ығысуына әсер етпейді, тек қана тепе-теңдікке тез жетуге жағдай туғызады.
Date: 2015-11-13; view: 5000; Нарушение авторских прав