
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Катализ және катализатор туралы түсінік
|
|
Реакция жылдамдығын катализаторлардың көмегімен жоғарылатуға болады. Температураны жоғарылатудан гөрі катализаторды қолданған тиімділеу, оның үстіне барлық кезде температураны көтеру мүмкін бола бермейді.
Химиялық реакцияның жылдамдығын өзгертетін заттарды катализаторлар деп атайды.
Кейбір катализаторлар реакцияны өте тез жылдамдатады — оларды оң катализ, немесе жай катализ деп атайды, ал кейбіреулері реакцияны баяулатады — оларды теріс катализ деп атайды. Оң катализдің мысалына платина катализатордың көмегімен күкірт қышқылының алынуы, аммиактың азо қышқылына тотығуы және т. с. с. Теріс катализдің мысалына этил спирті қатысқанда ауадағы оттегімен натрий сульфиті ерітіндісінің әрекеттесуінің бәсеңдеуі немесе аз мөлшердегі күкірт қышқылы (0,0001 м. б) қатысқанда сутегі пероксидінің беліну жылдамдығының баяулауы және т. б. жатады. Теріс катализді көбінесе ингибирлеу, ал реакция жылдамдығын бәсеңдететін теріс катализаторларды ингибиторлар (кейінгінің әсер ету механизмі катализаторларға қарағанда езгеше болады) деп атайды.
Катализаторлар қатысқанда жүретін химиялық реакцияларды катализдік реакциялар деп атайды.
Көптеген химиялық реакцияларға катализдік әсер етуге болады. Қатализаторлардың саны өте көп, ал олардын, катализдік активтілігі әртүрлі болады. Ол катализатор қатысқанда реакция жылдамдығының өзгеруімен анықталады.
Катализатордың өзі реакцияларда жұмсалмайды және соңғы өнімнің кұрамына кірмейді.
Катализдің екі түрі бар — гомогендік (бір текті) және гетерогендік (әртекті) қатализ.
Гомогендік катализде әрекеттесетін заттармен катализатор бір фазалы газ немесе сұйық күйдегі жүйені түзеді, катализатор мен әрекеттесуші заттар арасында бөліну беті болмайды. Мәселен тұздар ерітіндісі (сұйық күйінде) қатысқанда сутегі пероксидінің катализдік ыдырауы. Гомогенді катализ үшін химиялық реакцияның жылдамдығын катализатор концентрациясына пропорционал екендігі анықталған.
Гетерогенді катализде әрекеттесуші заттар мен катализатор әртүрлі фазалардан тұратын жүйе түзеді. Мұндай кезде катализатор мен әрекеттесуші заттар арасында бөліну беті болады. Әдетте катализатор — қатты зат, ал әрекеттесуші заттар — газдар немесе сұйықтықтар болады. Мәселен, платина қатысқанда (қатты күйдегі фаза) аммиактың тотығуы (газ күйіндегі фаза) немесе сутегі пероксидінің (сұйық күйіндегі фаза) көміртегі немесе марганец (IV) тотығы (қатты күйдегі фаза) қатысқанда ыдырауы. Химиялық реакциялардың барлығы гетерогендік катализде катализатордың бетінде жүреді. Сондықтан катализатордың активтігі оның бетінің қасиетіне (шамасына, химиялық құрамына, құрылысына және қалпына) тәуелді болады.
Оң катализатордың әсері — реакцияның активтендіру энергиясын төмендету, басқа сөзбен айтқанда, энергетикалық барьердің биіктігін төмендету (4.2-суретте пунктирмен көрсетілген). Мұнда энергия деңгейі төмендеу активтелген комплекс түзіледі де реакция жылдамдығы күшті артады.
Катализатордың әсер ету механизмін оның әрекеттесуші заттың біреуімен аралық қосылыс түзуі арқылы түсіндіруге болады. Егер баяу жүретін реакцияны А + В — АВ, катализатор К қатыстырып жүргізсе, онда ол әрекеттесуге катысатын заттардың біреуімен химиялық әрекеттесіп, тұрақсыз аралық қосылыс түзеді:

Бұл процесстің активтендіру энергиясы өте аз, сондықтан реакция шапшаң жүреді. Ал, түзілген аралық өнім АҚ енді келесі бастапқы затпен әрекеттесіп, катализаторды бөліп шығарады:
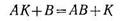
Бұл процестің де активтендіру энергиясы аз, сондықтан реакция айтарлықтай жылдамдықпен жүреді. Егер бір уақытта жүретін екі процесті біріктірсек, онда тез жүретін реакцияның ақтық теңдеуін аламыз:

Нақтылы мысал келтірейік — катализатор. N0 қатысқайда SО2-нің SO3-ке тотығу:
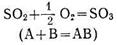
Бұл реакция баяу жүреді. Бірақта катализатор қосқанда аралық қосылыс түзіледі.

одан әрі

Катализатордың беті біртекті болмайды. Онда катализдік реакция жүретін активті орталықтар болады. Мұндай орталықтарда әрекеттесуші заттар сорылып жиналу нәтижесінде катализатор бетіндегі олардың концентрациясы артады. Бұл жағдай реакция жылдамдығының артуына әкеледі. Бірақ реакция жылдамдығының артуының негізгі себебі адсорбцияланған молекулалардың химиялық активтігінің күшті артуында. Катализатордың әсерімен адсорбцияланған молекулалардағы атомдар арасындағы байланыс әлсіреп олардың реакцияласу қабілеті артады. Мұндай кезде активтендіру энергиясының азайуы нәтижесінде реакция жылдамдығы шапшаңдайды (бұған беттік аралық қосылыстардың түзілу нәтижесінде қосылады).
Қейбір заттар қатты катализатордың активтігін төмендетеді немесе толық жойып жібереді. Мұндай заттарды катализдік у деп атайды. Мысал ретінде мышьяк, сынап, қорғасын, цианидты қосылыстарына платинадан жасалған катализаторлар өте сезімтал болады. Өндірісте әрекеттесетін заттарды катализдік удан тазартып, уланған катализаторларды қайтадан бастапқы қалпына келтіреді.
Кейбір заттар катализатордың берілген химиялық реакциядағы әсерін күшейтеді бірақ олар катализатор болып есептелмейді. Мұндай заттарды промоторлар деп атайды (платинадан жасалған катализаторды темір, алюминий және т. б. қосып промоторлайды).
Катализаторлардың талғаммен әсер ететіндігінен ерекше атап өту керек, осыған орай, әртүрлі катализатор қолдана отырып бір ғана заттан әртүрлі өнім алуға болады. Мәселен, алюминий оксиді Аl2О3 катализаторы қатысқанда 300°С-де этил спиртінен су мен этилен алынады.

Осы температурада, бірақ ұнталған мыс қатысқанда этил спиртінен сутегі мен сірке альдегиді алынады.

Әр реакция үшін өзінің оптимал катализаторы болатындығын тәжірибе көрсетті.
Катализаторлардың химиялық өндірістегі маңызы аса зор. Күкірт қышқылын алу, аммиакты синтездеу, қатты көмірден сұйық отын алу, мұнай мен табиғи газды өңдеу, жасанды каучукты пластмассаларды алу, майларды гидрогендеу — катализатор қолданылатын басты өндірістер болып есептеледі. Жаңа әрі жетілдірген катализаторлардың табылуы еңбек өнімділігін арттыруға және заттың өзіндік құнын кемітуге көмегін тигізетіні анық.
Ферменттер деп аталатын биологиялық катализаторлардың да ерекше орыны бар. Өсімдік және жануар организмдеріндегі күрделі химиялық процестер олардың қатысуымен жүреді.
4.5. Қайтымсыз және қайтымды реакциялар
Тек қана бір бағытта жүретін және бастапқы әрекеттесуші заттардың соңғы заттарға толық айналуымен аяқталатын реакцияны қайтымсыз реакция деп атайды.
Қайтымсыз реакцияға қыздырғанда (бертолле тұзы) калий хлораты мысал бола алады:

Калий хлораты калий хлориді мен оттегіге толық айналғанда ғана реакция тоқтайды. Қайтымсыз реакциялар онша көп емес. Реакциялардың көбі қайтымды болады.
Қайтымды реакциялар деп өзара қарама-қарсы екі бағытта да жүретін реакцияларды айтады.
Қайтымды реакциялар теңдеулерінің оң және сол жақтарының арасына қарама-қарсы жаққа бағытталған екі стрелка қояды. Қайтымды реакцияға сутегімен азоттан аммиакты синтездеу мысал болады:

Техникада қайтымды реакциялар, әдетте, тиімсіз. Сондықтан оларды әртүрлі әдістермен (қысымды, температураны және т.б. өзгерте отырып) іс жүзінде қайтымсыз реакцияға айналдырады.
Қайтымсыз реакцияларға олар жүрген кезде:
1) алынған өнімнің біреуі реакция сферасынан бөлініп тұнба түрінде, газ күйінде ұшып кететін, мысалы:

2) өте аз диссоцияланатын қосылыс түзілетін, мысалы су

3) реакция жүргенде өте көп жылу бөлініп шығатын, мәселен магнийдің жануы

реакциялар жатады.
Қайтымсыз реакция теңдеуінің оң және сол бөлігінің ортасына тепе-теңдік белгісі немесе стрелка қойылады.
Date: 2015-11-13; view: 9297; Нарушение авторских прав