
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства. Карбоксильная группа карбоновых кислот имеет сложное строение: она состоит из карбонильной группы С=О и гидроксильной группы –ОН
|
|
Карбоксильная группа карбоновых кислот имеет сложное строение: она состоит из карбонильной группы С=О и гидроксильной группы –ОН, которые влияют друг на друга.
Благодаря +M –эффекту ОН-группы в карбоксильной группе возникает рp -сопряжение, происходит выравнивание электронной плотности в ней и сведение полярности карбонильной группы до минимума. Этим объясняется инертность карбонильной группы в кислотах. +М –эффект гидроксильной группы объясняет также смещение электронной плотности в ней в сторону более электроотрицательного атома кислорода и диссоциацию кислот.
 |
(- I) – эффект гидроксильной группы поляризует связь С®ОН и делает возможным ее отщепление: группа ОН может отщепляться, что обусловливает реакции нуклеофильного замещения. Таким образом, главные реакции идут либо за счет замещения ОН - группы, либо за счет водорода этой группы.
1. Кислотные свойства Сила карбоновых кислот зависит от стабильности аниона, образующегося после отрыва протона. Стабильность аниона определяется, прежде всего, степенью делокализации отрицательного заряда: чем выше степень делокализации, тем стабильнее анион.
В карбоксилат-анионе заряд делокализуется по сопряженной системе, т. е. равномерно распределяется между двумя атомами кислорода карбоксилат–аниона, что придает ему стабильность:


|


 O
O


 R – C
R – C  (-)
(-) 

 (–) O
(–) O
В рамках класса сила кислот зависит от строения углеводородных радикалов и заместителей в них. Электронодонорные заместители ослабляют кислотные свойства, так как дестабилизируют карбоксилат–анион; электроноакцепторные заместители, оттягивая электронную плотность, способствуют делокализации заряда в карбоксилат – анионе и тем самым стабилизируют его, т.е. усиливают кислотные свойства.
Так, при введении в углеводородный радикал уксусной кислоты атомов хлора кислотность будет увеличиваться за счет электроноакцепторных свойств атома хлора:
Cl
СН3®СООН < СН2СООН < СlСНСООН < СlССООН
¯ ¯ ¯
Сl Cl Cl
рКа 4,76 2,85 1,25 0,66
Ароматические кислоты имеют более сильные кислотные свойства, чем незамещенные алифатические (для бензойной кислоты С6Н5-СООН рКа=4,19) – сказывается электронное влияние фенильного радикала (-I).
Кислотные свойства проявляются в реакции нейтрализации:
СН3 – СООН + NaOH  CH3COONa + H2O
CH3COONa + H2O
2. Реакции нуклеофильного замещения (SN):
 а) реакция этерификации:
а) реакция этерификации:
|
 Механизм реакции:
Механизм реакции:

 ..
..
НОС2Н5 -Н2О
 + Н+
+ Н+ 


 | |||
 | |||
-Н+


Реакция этерификации – обратимый процесс: прямая реакция – образование сложного эфира, обратная – его кислотный или щелочной гидролиз. Чтобы сдвинуть равновесие вправо, необходимо из реакционной смеси удалить воду
б) образование галогенангидридов:
Среди галогенангидридов наибольшее значение имеют хлорангидриды, которые получают при действии хлоридов фосфора (III) или фосфора (V):
 | |||
 |
 + PCl5 + POCl3 + HCl
+ PCl5 + POCl3 + HCl
хлористый ацетил
в) образование ангидридов кислот:
При действии сильных водоотнимающих агентов (P2O5, Al2O3) образуются ангидриды кислот:


___
½½ Al2O3 + H2O

 ½ ½
½ ½
Большое практическое значение имеет уксусный ангидрид, используемый для получения волокон (ацетатный шелк), многих лекарственных веществ. Применяется также для ацетилирования соединений.
Галогенангидриды и ангидриды очень реакционноспособны. При взаимодействии галогенангидридов с соединениями, содержащими атом металла или активный атом водорода, происходит замена его кислотным остатком. Подобные реакции называются ацилированием, в частности ацетилированием, если в молекулу входит ацетил, остаток уксусной кислоты.
В организме ацетилирующим реагентом является ацетилкофермент А - ключевой метаболит всех видов обмена в клетке.

г) образование амидов:
 | |||
 | |||
 + NH3 + HCl
+ NH3 + HCl
(амид уксусной
кислоты)
 | |||
 | |||

 O t° С
O t° С

 + NH3 CH3 – C + H2O
+ NH3 CH3 – C + H2O
 ONH4
ONH4
Амиды можно получить взаимодействием карбоновых кислот с аммиаком. Вначале образуются аммонийные соли, которые при нагревании теряют воду и превращаются в амиды. Амиды кислот подвержены различным превращениям. При нагревании с Р2О5 отщепляется вода и образуются нитрилы кислот:
 __
__
½ ½ t°, P2O5
 ½ ½ CH3–C = N + H2O
½ ½ CH3–C = N + H2O
½ ½ нитрил
½½ уксусной
кислоты
Все функциональные производные способны гидролизоваться с образованием карбоновых кислот:
 | 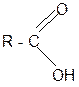 | ||
 + Н2О + НХ
+ Н2О + НХ

 ___
___
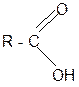
 ______ ½ ½
______ ½ ½
½ H½OH ½ ½

 R-C = ½ N + H½OH ___
R-C = ½ N + H½OH ___
½ H½ OH -NH3 -H2O
При образовании функциональных производных карбоновых кислот мы сталкиваемся с двумя видами кислотных радикалов:
 | |||
 | |||
Date: 2015-10-22; view: 576; Нарушение авторских прав