
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства d-элементов VII группы
|
|
Электронные формулы элементов. Степени окисления, валентность. Характер изменения радиусов атомов, энергии ионизации в ряду Mn – Re, изменение устойчивости соединений с различными степенями окисления.
Марганец, получение, химические свойства (положение в ряду напряжений, взаимодействие с кислотами, кислородом, галогенами).
Оксиды и гидроксиды марганца в различных степенях окисления хрома (II, IV, VI, VII). Зависимость кислотно-основных свойств оксидов и гидроксидов от степени окисления. Окислительно-восстановительные свойства соединений марганца с различной степенью окисления (II, IV).
Кислоты H2MnO4, HMnO4, их устойчивость. Манганаты и перманганаты, их получение из оксида марганца (IV). Окислительные свойства перманганата в зависимости от среды. Сопоставление свойств p- и d-элементов VII группы.
Вопросы и задачи: 12, с. 17, № 1–55.
1. Какой объем при н.у. займет газ, выделившийся в результате взаимодействия концентрированной соляной кислоты с 500 мл 0,1 М КMnO4? (Ответ: V = 2,8 л)
2. Вычислить молярную массу эквивалента FeSO4 в реакции его взаимодействия с КMnO4, если известно, что на титрование 100 мл 0,1 М подкисленного раствора сульфата железа израсходовано 20 мл 0,1 М раствора перманганата калия.
(Ответ: M(1/z*) = 152 г/моль)
3. Рассчитать температуру, при которой давление углекислого газа над карбонатом марганца (II) составляет 1 атм. (Ответ: Т = 622,2 К)
4. Провести термодинамические расчеты для процесса алюмотермического восстановления Mn3O4: 3[Mn3O4] + 8[Al] = 4[Al2O3] + 9[Mn]. Указать интервал температур, при которых этот процесс термодинамически возможен. (Ответ: Т < 12737 К)
5. Выразить растворимость сульфида марганца (II) в моль/л и в г/л. Какой объем воды понадобится для растворения 1 г этой соли?
(Ответ: См = 8,37.10–9 моль/л, С = 7,28.10–7 г/л)
6. Выпадет ли осадок при смешивании равных объемов 0,02 н. раствора хлорида марганца (II) и 0,1 н. раствора карбоната натрия? (Ответ: да, ПС = 1,25.10–4)
7. Объяснить, почему комплексы [MnCl6]2– и [CrCl6]3– имеют одинаковые магнитные свойства? Каким типом гибридизации орбиталей центральных атомов определяется геометрическая форма этих ионов?
8. Составить молекулярно-ионные уравнения реакций. Для б) определить Кс реакции (Т = 298 К): а) КMnО4 + Br2 + H2SO4 →; б) KMnO4 + K2SO3 + H2O →. (Ответ: 3,9.10155)
9. Можно ли при стандартных условиях окислить азотной кислотой, которая восстанавливается до NO: а) Fe2+ до Fe3+, б) Mn2+ до MnO4–? Ответ подтвердить расчетом Δ G 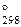 . (Ответ: а) да, Δ G
. (Ответ: а) да, Δ G 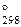 = –55 кДж; б) нет, Δ G
= –55 кДж; б) нет, Δ G 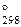 = 796 кДж)
= 796 кДж)
10. Сравните окислительную способность MnO4– в различных средах. В какой среде при стандартных условиях окислительные свойства MnO4- проявляются в большей степени? Приведите примеры реакций.
Литература: 1, с. 618–630; 2, с. 507–529.
ЛИТЕРАТУРА
1. Ахметов Н.С. Общая и неорганическая химия. − М.: Высшая школа, 2002.− 743 с.
2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. − М: Химия, 1992. − 592 с.
3. Жарский И.М., Кузьменко А.Л., Орехова С.Е. Теоретические основы химии: Сборник задач. – Мн.: Аверсэв, 2004. – 397 с.
4. Жарский И.М., Кузьменко А.Л., Орехова С.Е. Лабораторный практикум по общей и неорганической химии. − Мн.: Дизайн ПРО, 1998. − 224 с.
5. Новікаў Г.І., Жарскі І.М. Асновы агульнай хіміі. − Мн.: Вышэйшая школа, 1995. – 656 c.
6. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. – М.: Высшая школа, 1997. − 384 с.
7. Ашуйко В.А., Хмылко Л.И., Новикова Л.Н. Основные классы неорганических соединений. Учебно-методическое пособие для студентов химических специальностей. – Мн.: БГТУ, 2004.
8. Хмылко Л.И., Новикова Л.Н., Ашуйко В.А. Растворы. Способы выражения состава растворов. Методические указания для студентов химических специальностей. – Мн.: БГТУ, 2004 г.
9. Матвеева Т.А., Орехова С.Е. Методические указания и контрольные задания по дисциплине «Общая и неорганическая химия» для самостоятельной работы студентов. – Мн.: БГТУ, 1988.
10. Матвеева Т.А., Орехова С.Е. Гидролиз солей. Комплексные соединения. Окислительно-восстановительные процессы. Методические указания и контрольные задания по дисциплине «Общая и неорганическая химия». – Мн.: БГТУ, 1991.
11. Орехова С.Е., Малашонок И.Е., Курило И.И., Мазец А.Ф. Окислительно-восстановительные процессы. Задания многоуровневой сложности по одноименным разделам для самостоятельной работы студентов 1 курса химических специальностей. – Мн.: БГТУ, 2003.
12. Арэхава С.Я., Ашуйка В.А. Неарганічная хімія. Метадычныя ўказанні да самастойнай работы па аднайменным курсе для студэнтаў хімічных спецыяльнасцей. – Мн.: БДТУ, 1999.
13. Ашуйко В.А., Малашонок И.Е., Хмылко Л.И. Неорганическая химия. Методические указания и контрольные задания для студентов химических специальностей. – Мн.: БГТУ, 2002.
СОДЕРЖАНИЕ
Введение………………………………………………………………..3
1. Атомно-молекулярное учение. Газовые законы…………………...4
2. Основные классы неорганических соединений……………………...4
3. Эквивалент. Закон эквивалентов……………………………………...5
4. Термохимия…………………………………………………………….5
5. Химическое равновесие. Константа химического равновесия……..5
6. Энтропия………………………………………………………………..6
7. Изменение энергии Гиббса…………………………………………....6
8. Смещение химического равновесия. Принцип Ле Шателье………...7
9. Растворы………………………………………………………………...7
10. Электролитическая диссоциация. Равновесие в растворах
слабых электролитов………………………………………………….8
11. Произведение растворимости. Условия образования и
растворения осадков………………………………………………….8
9. Гидролиз солей………………………………………………………...9
10. Комплексные соединения……………………………………………10
11. Окислительно-восстановительные реакции………………………..10
12. Электродные потенциалы……………………………………………11
13. Электролиз……………………………………………………………11
14. Строение атома. Электронные конфигурации элементов…………12
15. Химическая связь и строение молекул.…………………………….12
16. Свойства водорода…………………………………………………..14
17. Свойства р-элементов VII группы………………………………….15
18. Свойства р-элементов VI группы….……………………………….17
19. Свойства р-элементов V группы….………………………………..20
20. Свойства р-элементов IV группы….……………………………….22
21. Свойства р-элементов III группы…………………………………..24
22. Свойства s-элементов II группы……………………………………26
23. Свойства s-элементов I группы…………………………………….27
24. Свойства d-элементов VI группы….……………………………….29
25. Свойства d-элементов VII группы………………………………….30
Литература…………………………………………………………..32
Date: 2015-09-24; view: 618; Нарушение авторских прав